
实验室用乙醇和必要的无机试剂制取1,2-二溴乙烷的装置如下图,1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm,3沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。请回答以下问题:
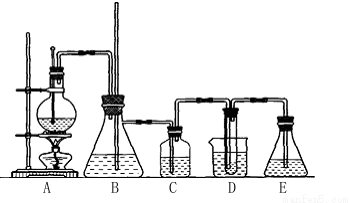
(1)装置A的烧瓶中装入乙醇和浓硫酸的混合液后还需加入 。
烧瓶内发生的反应的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中盛有10%的NaOH溶液,其作用是 。
(4)装置D中试管中装有液溴,实验开始后观察到的主要现象是 。
(5)开始反应时需向装置D中的烧杯里加入冰水,这是为了 。
(6)装置E的作用 。
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.SO2、NO、SiO2都是酸性氧化物
B.PM2.5是指大气中直径接近于2.5×l0 -6m的颗粒物,它在空气中形成气溶胶
C.向蛋白质溶液中滴加CuSO4溶液产生沉淀属于化学变化
D.KCl和SO3溶于水后均能导电,是因为KC1和SO3都为电解质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期期中测试化学试卷(解析版) 题型:选择题

 下列各组物质互为同系物的是
下列各组物质互为同系物的是
A.CH4与C2H4
B.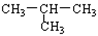 与 CH3-CH2-CH2-CH3
与 CH3-CH2-CH2-CH3
C.C2H6与C3H8
D.O2与O3
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:实验题
ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂.已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与纯净的氯气反应 2NaClO2+Cl2═2ClO2+2NaCl
如图1是实验室用于制备和收集一定量纯净的ClO2的装置(某些夹持装置和垫持用品省略).其中E中盛有CCl4液体.

(1)仪器P的名称是
(2)写出装置A中烧瓶内发生反应的化学方程式:
(3)E装置中所盛试剂的作用是
(4)F处应选用的收集装置是图2 (填序号),其中与E装置导管相连的导管口是图2 (填接口字母).

(5)以下是尾气吸收装置,能用于吸收多余ClO2气体,并能防止倒吸的装置的是如图3的

A.①② B.②③ C.③④ D.②④
(6)若用100mL 2mol•L﹣1的浓盐酸与足量的MnO2制备Cl2,则被氧化的HCl的物质的量是 (填序号).
A.>0.1mol B.0.1mol C.<0.1mol D.无法判断.
(7)ClO2也可由NaClO3在H2SO4溶液存在下与Na2SO3反应制得.请写出反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期期中模块测试化学试卷(解析版) 题型:填空题
I 铁及其化合物之间的相互转化可用下式表示:
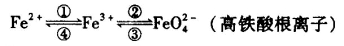
回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2 = 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________,每生成l mol Na2FeO4转移____________mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________。
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
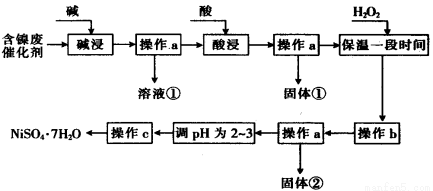
部分阳离子以氢氧化物形式沉淀时的pH如下:

(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷(解析版) 题型:选择题
将4 mol SO2与2 mol O2放入4L的密闭容器中,在一定条件下反应:2SO2(g)+O2(g) 2SO3(g),测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K(单位为L·mol-1)为
2SO3(g),测得平衡时SO3的浓度为0.5 mol·L-1。则此条件下的平衡常数K(单位为L·mol-1)为
A.4 B.0.25 C.0.4 D.0.2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:填空题
(1)0.1molO2中,含有 mol O;
(2)标准状况下,67.2L Cl2的物质的量为 mol;
(3)4gNaOH固体的物质的量为 mol,将其溶于水配成500mL溶液,此溶液中NaOH的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:选择题
下列变化过程中,需要加入还原剂才能实现的是
A.Fe → FeSO4 B.SO2 → S C.CO →CO2 D.HCl → Cl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:填空题
17gNH3共有 mol氢原子,0.1molH2S共有约 个原子,同温同压下,同体积的NH3和H2S气体的质量比为 ;同温同压下,同质量的NH3和H2S气体的体积比为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com