
【题目】图甲是利用一种微生物将废水中尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置在图乙中的铁上镀铜。下列说法中错误的是 ( )
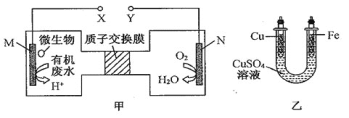
A.铜电极应与Y电极相连接
B.H+通过质子交换膜由左向右移动
C.当N电极消耗0.25mol气体时,则铁电极增重16g
D.M电极的电极反应式为CO(NH2)2 + H2O -6e- = CO2↑ +N2↑ +6H+
【答案】C
【解析】
甲图是将化学能转化为电能的原电池,电解质溶液为酸性溶液,M电极是负极,尿素在负极上失电子发生氧化反应,N电极是正极,氧气在正极上得电子发生还原反应;乙图是铁上镀铜的电镀装置,铜与原电池正极相连做阳极,铁与负极相连做阴极。
A项、铁上镀铜时,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故A正确;
B项、M是负极,N是正极,H+通过离子交换膜由M极移向N极,即由左向右移动,故B正确;
C项、当N电极消耗0.25 mol氧气时,装置中转移0.25mol×4=1 mol电子,由得失电子数目守恒可知铁电极增重的质量为0.5mol××64 g·mol-1=32 g,故C错误;
D项、尿素在负极M电极上失电子发生氧化反应生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-=CO2↑+N2↑+6H+,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并与氨气充分反应后,停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为___;装置C的主要作用是___。
(2)步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为___。步骤③中最适宜的加热方式为____(填“水浴加热”,“油浴加热”)。
(3)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是(填序号)___。
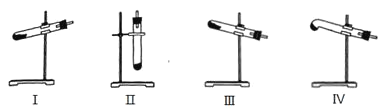
(4)生成NaN3的化学方程式为____。
(5)图中仪器a用的是铁质而不用玻璃,其主要原因是____。
(6)步骤④中用乙醚洗涤的主要目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的NaOH标准溶液滴定20.00 mL0.1000 mol/L的HCl溶液,滴定曲线如图,下列有关说法正确的是( )
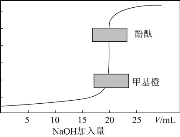
A.指示剂变色时,说明反应的酸、碱恰好等物质的量反应
B.当达到滴定终点时才存在c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.达到滴定终点时,用甲基橙作指示剂消耗NaOH溶液体积比用酚酞多
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,上述滴定恰好中和时,放出114.6J的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
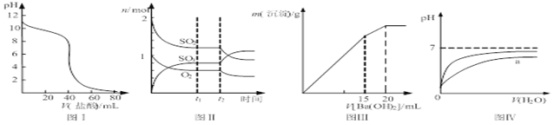
A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O2![]() 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示不正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
B.C(金刚石,s)=C(石墨,s) △H=-1.19kJ·mol-1,所以石墨比金刚石稳定
C.含1mol H2SO4的浓硫酸与足量的NaOH溶液反应,放出热量为57.3kJ
D.在101 kPa下,2 g H2 完全燃烧生成液态水放出285.8kJ热量,其热化学方程式为H2(g)+![]() O2
O2![]() H2O(l) △H=-285.8kJ·mol-1
H2O(l) △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山银山,保护环境人人有责。直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
(1)由上表判断NaHSO3溶液显_____性。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______。
(4)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______(选填字母)。
A. c(Na+)=2c(SO32-)+c(HSO3-)
B .c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C. c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(5)氮的氢化物之一肼(N2H4)-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%-30%的KOH溶液,负极的电极反应式是_______________,若使用该电池做电源,惰性电极电解500mL 1mol/L的CuSO4溶液,一段时间后溶液的PH=1,消耗的N2H4质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
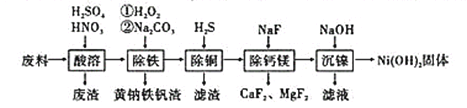
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
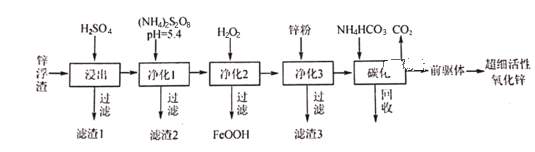
(1)滤渣1的成分为___________。
(2)在S2O82-的结构式中只含有一根“O一O”非极性键,则S的化合价为___________;工业上常用惰性电极电解(NH4)2SO4生产(NH4)2S2O8(过二硫酸铵),阳极电极反应式为__________________。净化1是为了将Mn2+转化为MnO2而除去,写出该反应的离子方程式:______________________。
(3)净化3的目的_________________________________。
(4)碳化回收溶液的主要成分为___________,该物质循环使用的目的___________________。
(5)碳化在50℃进行,“前驱体”的化学式为ZnCO3·2Zn(OH)2·H2O,写出碳化过程生成“前驱体”的化学方程式:__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com