
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L乙醇中含有的氧原子数目为0.1NA
B.1 L 1mol/L的NaHCO3溶液中Na+、H+和CO32-的数目均为NA
C.16 g的O2和O3混合气体中所含原子总数为NA
D.18 g水中所含电子总数为8NA
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。
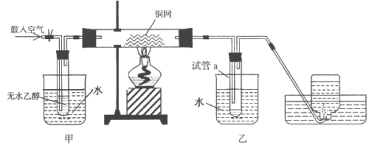
(1)实验过程中铜网出现红色和黑色交替的现象,请写出铜网由黑变红的化学方程式:________;在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_____ 反应。
(2)甲和乙两个水浴作用不相同。甲的作用是_______________;乙的作用是_________________。
(3)反应进行一段时间后,干燥试管a中能 收集到不同的物质,它们是_____。集气瓶中收集到的气体的主要成分是 ________________。
(4)试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有____________ 。要除去该物质,可在混合液中加入______(填写字母),然后再通过___________(填实验操作名称)即可除去。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,我国某物理研究所取得重大科技成果,研制出由18O所形成的单质气体。18O是一种稳定的同位素,称为重氧。下列有关说法不正确的是( )
A.1.8 g18O形成的气体的物质的量是0.05 mol
B.0.1 mol重氧水H218O所含的中子数约为6.02×l023个
C.0.2 mol18O2气体的体积约为4.48 L
D.18O2气体的摩尔质量为36 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氧化铜与稀盐酸混合:CuO+2H+=Cu2++H2O
B.稀硫酸与氢氧化钡溶液混合:SO![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
C.用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH
+OH![]() =CaCO3↓+H2O
=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_______________________________;
(2)写出②的离子化学方程式_____________________________________________;
(3)Cl2、H2SO4和KMnO4的氧化性由强到弱的顺序为________________________;
(4)反应②中氯化氢表现出的性质是________。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g); C(s)+![]() O2(g)===CO(g)
O2(g)===CO(g)
②S(s)+O2(g)===SO2(g); S(g)+O2(g)===SO2(g)
③H2(g)+![]() O2(g)===H2O(l); 2H2(g)+O2(g)===2H2O(l)
O2(g)===H2O(l); 2H2(g)+O2(g)===2H2O(l)
④2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l);2KOH(aq)+H2SO4(浓)===K2SO4(aq)+2H2O(l)
⑤NaOH(aq)+HCl (aq)===NaCl (aq)+H2O(l); NaOH(aq)+HF(aq)===NaF(aq)+H2O(l)
A. ①③⑤B. ②④⑤C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是原电池的装置图。请回答:
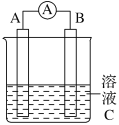
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________;
(2)若需将反应:Cu+2Fe3+===Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为______,B(正极)极材料为________,溶液C为________。
(3)若C为CuCl2溶液,Zn是________极,Cu电极反应为_________________。反应过程溶液中c(Cu2+)________(填“变大”“变小”或“不变”)。
(4)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
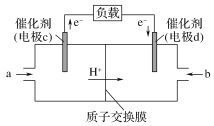
电池总反应为2CH3OH+3O2===2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的反应方程式为________。若线路中转移2 mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下列方程式得出的结论不正确的是
A. C(石墨,s)=C(金刚石,s) △H>0,说明石墨比金刚石稳定
B. NH3+H3O+=NH4++H2O,说明NH3结合H+能力比H2O强
C. 2HCl+CaCO3=CaCl2+CO2↑+H2O,说明盐酸是强酸
D. CH3COO-+H2O![]() CH3COOH+OH-,说明CH3COOH是弱电解质
CH3COOH+OH-,说明CH3COOH是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、钴、铜等金属及其化合物在工业上有重要用途。请回答:
(1)基态铬原子的价电子排布图为___________。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O2+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述反应式中非金属元素电负性由大到小的顺序是__________(用元素符号表示)。
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于__________晶体。
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配离子的化学式为___________。
(3)Co3+与NO2―形成的配合物与K+生成黄色沉淀检验溶液中的K+。配体NO2―的立体构型为__________,某常见气体化合物为NO2―的等电子体,该化合物的分子式为__________。
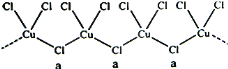
(4)氯和钾与+2价的铜可生成一种催化乙炔聚合反应的化合物,其阴离子为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为________杂化,这种化合物的化学式为_________
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:_____。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是_____g/cm3(设阿伏加德罗常数的值为NA)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com