
| A、化学反应过程中的能量变化除了热能外,还可以是光能、电能等 |
| B、放热反应的△H<0 |
| C、需要加热才能发生反应一定是吸热反应 |
| D、热化学方程式中的化学计量数仅表示该物质的物质的量,可以是分数 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
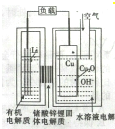 近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )
近年来科学家正在研制一种高容量、低成本锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀现象产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )| A、放电时,Li+透过固体电解质向Cu极移动 |
| B、放电时,负极的电极反应式为CuO+H2O+2e---Cu+2OH- |
| C、通空气时,铜被腐蚀,表面产生Cu2O |
| D、整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
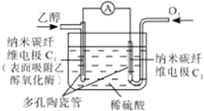 生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池.其工作原理如图所示.下列有关说法正确的是( )
生物燃料电池是以有机物为燃料,直接或简介利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池.其工作原理如图所示.下列有关说法正确的是( )| A、、O2在C2电极上得电子,被氧化 |
| B、电子由C2极经外电路流向C1极 |
| C、每转移6mole-1,理论上生成22.4LCO2 |
| D、C1极的电极反应式为:C2H5OH+3H2O-12e-1=2CO2+12H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、日常生活中看到的云、烟、雾 |
| B、蒸发饱和食盐水析出氯化钠晶体 |
| C、向豆浆中加入盐卤做豆腐 |
| D、光线射入蛋白质溶液里,形成光亮的通路 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.1 mol Cl2 溶于水,转移的电子数目为0.1NA |
| B、常温常压下,18 g H2O 中含有的原子总数为3NA |
| C、1 L 0.1 mol?L-1NaHCO3液含有0.1NA个HCO3- |
| D、常温常压下,2.24 L CO 和CO2 混合气体中含有的碳原子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体积 | 所消耗演算标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com