
����Ŀ�����ȹ��飨SiHCl3���ڿ����м���ȼ�գ�����ˮ��Ӧ���������ᣬ��Ҫ���������ྦྷ�衢���͵ȣ��۵�Ϊ134 �����е�Ϊ31.8 ������֪�Ȼ��������ڼ��������¿��뵥�ʹ跴Ӧ�õ����ȹ��飬ijͬѧ������ͼװ���Ʊ�һ���������ȹ��飨����װ�þ�ʡ�ԣ���

��1���Ʊ�HCl����ķ���֮һ�ǽ�Ũ������Ũ�����ϣ������������Ʊ�ԭ���ص���______������ĸ����Bװ�õ�������___________________������ˮ��������________________________��
A��Ũ���������ˮ�� B��Ũ���������ˮ��
C��������лӷ��� D��������ܽ�����¶����߶�����
��2��ʵ�鿪ʼ������Ҫͨ��һ��ʱ���HCl����������C���Լ����ȣ�Ŀ���ǣ����ų�װ���п�������ֹ����������Ӧ����_____________________������ʵ��װ�����������ԵĴ�����E�л������������____________________��Eװ�õ���;��_______________________��
��3�����������£�C�з��������û���Ӧ����Ӧ�Ļ�ѧ����ʽΪ________________________��
��4���Ƶõ�SiHCl3�к�������SiCl4���е�Ϊ57.6 �������ᴿSiHCl3���õ����˷���Ϊ__________���ռ�SiHCl3ʱ�¶�Ӧ������_____________��
��5�����һ��ʵ��֤��C�в�����������H2��_______________________________��
���𰸡���1��A ��ȥHCl�����е�ˮ���� ��ȴ���ɵ�SiHCl3��ʹ��Һ�����Ա��ռ�
��2����ֹ���ɵ�SiHCl3��������Ӧ D��E֮��ȱ��һ��ʢ��Ũ����ĸ���װ�� ����HCl���壬��ֹ����Ⱦ����
��3��Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
��4������ 31.8 ��
��5����ȼEװ�ó��ڴ������壬������ȼ�ղ�������ɫ���棬�����������ձ����ڻ����Ϸ����ձ�������ˮ��
����������1��Ũ������Ũ��������ȡHCl���壬������Ũ�������ˮ�ԡ�����Ļӷ����Լ�������ܽ�����¶����ߣ�Ũ������ˮ���ȣ������͵����ʣ���Ũ�������ˮ���أ���ѡA��Bװ��װ�и���������ڳ�ȥHCl�����е�ˮ����������ˮ����������ȴ���ɵ�SiHCl3��ʹ��Һ�����Ա��ռ�������
��2���������Ϣ֪SiHCl3�ڿ����м���ȼ�գ�������ˮ��Ӧ����ͨ��һ��ʱ��HCl���壬�ų�������Ŀ��֮���Ƿ�ֹ���ɵ�SiHCl3��������Ӧ������װ��ȱ��֮����D��E֮��ȱ��һ������װ�ã�����E��ˮ�������������Թ�����SiHCl3��Ӧ��HCl������Cװ��������Ӧ�꣬��E����������HCl���壬��ֹ����Ⱦ������
��3���û���Ӧ���ɵĵ�����H2��
��4��SiHCl3��SiCl4�е����ϴ����˵ķ��뷽���������ռ�31.8 ��ʱ����ּ��õ�SiHCl3��
��5������Eװ�ó��ڴ���ȼ���壬����ȼ��ʱ��������ɫ���棬�����������ձ����ڻ����Ϸ����ձ�������ˮ�飬˵�����������ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ԫ�����ڱ��С����ڡ���˵���������
A. Ԫ�����ڱ������ĸ������ڡ�����������
B. ͬһ��������Ԫ��ԭ�ӵĺ�����Ӳ�����ͬ
C. ͬһ��������Ԫ��ԭ�ӵļ۵�����Ŀ��ͬ
D. Ԫ�����ڱ���ÿ�����ھ��ӽ���Ԫ�ؿ�ʼ���Էǽ���Ԫ�ؽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ĺ�ҵԭ�ϡ�
��.ʵ���ҿ��ö������̺�Ũ���ᷴӦ��ȡ��������Ӧ�Ļ�ѧ����ʽ��________��
��.ij�о���ѧϰС��������ϵ�֪��Ư�������ᷴӦ����ȡ��������ѧ����ʽΪ��Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2��+2H2O�������ø÷�Ӧ���������ȡ��������֤�����ʵ�ʵ�顣
2CaSO4+2Cl2��+2H2O�������ø÷�Ӧ���������ȡ��������֤�����ʵ�ʵ�顣

�ش��������⣺��1����ʵ����A���ֵ�װ����_______(����)��
��2����������������һ��ʵ�飬֤��ϴ��ƿC�е�Na2SO3�ѱ�����(����ʵ�鲽��)��_____________________________��
��3��д��Dװ���з�����Ӧ�����ӷ���ʽ_________________
��4����ʵ��������Ե�ȱ�ݣ���������Ľ��ķ���__________________________________________д����Ӧ���ӷ���ʽ_____________________________________��
��5����С���ֽ���������ʵ�飺��ȡƯ��2.0 g����ĥ���ܽ⣬���Ƴ�250 mL��Һ��ȡ��25 mL���뵽��ƿ�У��ټ��������KI��Һ������H2SO4��Һ�����á�����ȫ��Ӧ����0.1 mol.L1��Na2S2O3��Һ����Һ�ζ���Ӧ���ɵĵ⣬��֪��Ӧ����ʽΪ��2Na2S2O3+I2===Na2S4O6+2NaI������ȥNa2S2O3��Һ20.0 mL�����Ư����Ca(ClO)2����������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����κ������£���ˮ�����ԣ�������Ϊ �� ��
A��PH=7 B��c��H+��=c��OH-��
C��c��H+��=c��OH-��=10-7mol/L D��c��H+����c��OH-��=10-14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȳ�����Ũ�������ֲ����ü�ʯ�Ҹ������
A. NH3 B. H2S C. SO2 D. HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ũ�����̿��ʵ�������������д̼�����ζ�����壬�Ի���������Ⱦ��Ϊ�ˣ�ij��ѧ��ȤС�����������װ�ý���ʵ�顣���������٢ڢ��ֱ�ΪCO�����ֽ�������Ȼ�����Һ����ֽ����CO���ɫ��������Ʒ����Һ����ֽ����������KMnO4��Һ����ֽ��a��b�ֱ�Ϊ����С����
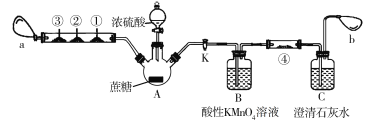
ʵ�鲽�����£���ͼʾ���Ӻ�������Ȼ����װ�õ������ԣ�װ���Լ����н�ֹˮ��K����Aƿ�е�������С�ĵμ�Ũ���ᣬƬ�̺�ɹ۲쵽Aƿ�����DZ�ڣ�������ͣ��а�������������a���𣬲�������������ֽ�ɰ�ɫ���ɫ�����ź�������ֽ����ɫ����ش��������⣺
��1����ͼ��ʢװŨ�������������Ϊ________����������Ӧ������ȼ�ƾ��Ʋ������ź�������ֽ�IJ����ܸ������ȼ��ȣ��۲쵽��������____________________��
��2��Bƿ������KMnO4��Һ��������___________________________��������Ӧ�����ӷ���ʽΪ________________________________��
��3����ֹˮ��K��ʹ����a�����建��ͨ��Bƿ��Cƿ��һ��ʱ��֮���ֳ���ʯ��ˮ����ǣ�����������֤���÷�Ӧ������CO2��Ϊ��֤����CO2���ɲ���ʵ��װ�ã���������λ�÷��ϵ���__________����ֽ���������Լ���ѡ��
A��Ʒ����Һ B�����Ը��������Һ C����ˮ D������ʯ��ˮ
��4������Ӧ���ɵ�����̼������������ͬ�����µ������Ϊ2��1��������̿����������ͷ�����Ӧ�Ļ�ѧ����ʽ����Ϊ_______________________________��������������ԭ��Ӧ�����õ����ŷ��ڻ�ѧ����ʽ�ϱ�������ת�Ƶķ������Ŀ����
��5������β��û������b������ʲô���������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2017�¿α���]ˮ�е��ܽ�����ˮ���������治��ȱ�ٵ�������ij����С����õ������ⶨѧУ�ܱߺ�ˮ�е��ܽ�����ʵ�鲽�輰�ⶨԭ�����£�
����ȡ�������Ĺ̶�
���ܽ���ƿ�ɼ�ˮ������¼����ѹ��ˮ���¶ȡ���ˮ����Mn(OH)2��������Һ������KI����ϣ���Ӧ����MnO(OH)2��ʵ�����Ĺ̶���
�����ữ���ζ�
���������ˮ���ữ��MnO(OH)2��I��ԭΪMn2+���ڰ�������5 min��Ȼ���ñ�Na2S2O3��Һ�ζ����ɵ�I2��2![]() +I2=2I+
+I2=2I+![]() ����
����
�ش��������⣺
��1��ȡˮ��ʱӦ���������Ŷ�ˮ����棬������������ҪĿ����_____________��
��2�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ_______________��
��3��Na2S2O3��Һ���ȶ���ʹ��ǰ��궨�����Ƹ���Һʱ��Ҫ�IJ����������ձ������������Լ�ƿ��____________������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������____��������̼��
��4��ȡ100.00 mLˮ�����������ữ����a mol��L1Na2S2O3��Һ�ζ����Ե�����Һ��ָʾ�����յ�����Ϊ________________��������Na2S2O3��Һ�����Ϊb mL����ˮ�����ܽ����ĺ���Ϊ_________mg��L1��
��5�������ζ����ʱ�����ζ��ܼ��촦�������ݻᵼ�²������ƫ___________������ߡ��͡���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�����Ϊ95 g���Ȼ�þ�ܽ���0.2 Lˮ����ˮ���ܶȽ���Ϊ1 g/mL��ǡ�õõ��Ȼ�þ�ı�����Һ��������Һ���ܶ�Ϊ�� g/mL�����ʵ���Ũ��Ϊc mol/L���ܽ��Ϊs��NA��ʾ�����ӵ�������ֵ����������������ȷ������������
A. ������Һ�к���NA���Ȼ�þ����
B. ������Һ�����ʵ���Ũ��Ϊ5 mol/L
C. ������Һ���ܽ�ȿɱ�ʾΪ9500 c/��1000��-95c��
D. ������Һ�����������ɱ�ʾΪ95 ��/��1000c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ѧ2017��ڶ���ģ�⡿����Ա����������CO2�����з�Ӧ��������ʵ�ֿռ�վ��O2��ѭ�����á�
sabatior��Ӧ��CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
ˮ��ⷴӦ��2H2O(l)![]() 2H2(g) + O2(g)
2H2(g) + O2(g)
��1����ԭ������nCO2��nH2=1:4�����ܱ������з���Sabatier��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ��ͼ��ʾ(���߱�ʾƽ������)��
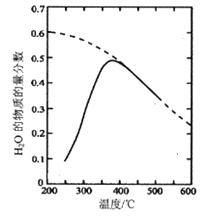
�ټ�֪H2(g)��CH4(g)��ȼ���ȷֱ�ΪA kJ/mol��BkJ/mol�� H2O(l)=H2O(g) ��H =C kJ��mol������Sabatier��Ӧ�ġ�H=___kJ/mol��
���¶ȹ�����;������ڸ÷�Ӧ�Ľ��У�ԭ����________��
��200��ﵽƽ��ʱ��ϵ����ѹǿΪp���÷�Ӧƽ�ⳣ��Kp�ļ���ʽΪ________��(���ػ�����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�������)
��2��Sabatier��Ӧ�ڿռ�վ����ʱ�����д�ʩ�����CO2ת��Ч�ʵ���______(����)��
A.�ʵ���ѹ B.��������ıȱ����
C.��Ӧ��ǰ�μ��ȣ������ȴ D.���ԭ������CO2��ռ����
E.�������Ʒ�Ӧ�������������
��3�� һ���µ�ѭ�����÷�������Bosch��ӦCO2(g)+2H2(g)![]() C(s)+2H2O(g)����Sabatier��Ӧ��
C(s)+2H2O(g)����Sabatier��Ӧ��
��250�棬�����Ϊ2L�Ҵ���ѹ�Ƶĺ����ܱ�������ͨ��0.08molH2��0.04molCO2����Bosch ��ӦCO2(g)+2H2(g)![]() C(s)+2H2O(g) �� H
C(s)+2H2O(g) �� H
������Ӧ��ʼ��ƽ��ʱ�¶���ͬ(��Ϊ250��)����÷�Ӧ������ѹǿ(P)��ʱ��(t)�ı仯��ͼI ����a��ʾ�����H___ 0(�>����<����ȷ����) ��������������ͬ�����ı�ijһ����ʱ�������ѹǿ(P)��ʱ��(t)�ı仯��ͼI ����b��ʾ����ı��������______________��
��ͼII�Ǽס�����ͬѧ���������Ӧƽ�ⳣ���Ķ���ֵ(lgK)���¶ȵı仯��ϵ��������ȷ��������____________(��ס����ҡ�)��mֵΪ____________��

��Bosch��Ӧ�����ڸ����²���������ԭ����__________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com