
��������A�к���Ԫ��LiԪ�أ�A��Ħ������23g·mol-1��A��Ҫ�����л��ϳɺ�ҩ�����죬ͬʱҲ�����õĴ�����ϡ���һ�������£�0.1mol����A��0.1molNH4Cl����ǡ����ȫ��Ӧ�����ɹ���B��4.48L(��״��)����C����֪����C��������ˮ���ҵõ�������Һ�������ˮB�����ɽ�������D����������ش��������⣺
��1��A�Ļ�ѧ��ʽ��_________________________��
��2��д��������A��NH4Cl��Ӧ�Ļ�ѧ����ʽ:_______________________________��
��3��ijͬѧͨ���������ϵ�֪����A�����ʣ�
I.��ҵ�Ͽ��ý���D��Һ̬��C�����������·�Ӧ���Ʊ�A���ʡ�
II.����A��ˮǿ��ˮ�⣬�ͷų�����C��
��I�з�����Ӧ�Ļ�����Ӧ������__________________________��
������A��ˮǿ��ˮ��Ļ�ѧ����ʽΪ_________________________��
��4����ҵ�Ʊ�����D���������£�
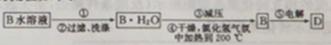
�ٲ�����в���������Ϊ________________��
������ƽ��ԭ�����Ͳ�����м�ѹ��Ŀ���ǣ�_________________________��
��֪ʶ�㡿������ƶϣ��Ʊ�ʵ�鷽������� C1 J5
���𰸽�����(1)LiNH2(2��) ��2��LiNH2��NH4Cl=LiCl��2NH3��
(3)���û���Ӧ(1��) ��LiNH2��2H2O=LiOH��NH3��(2��)
(4)������Ũ������ȴ�ᾧ LiCl·H2O(s) LiCl(s)��H2O(g)����Сѹǿ��������ƽ��������Ӧ�����ƶ����Ӷ���������ˮLiCl���Ʊ�����2�֣�
LiCl(s)��H2O(g)����Сѹǿ��������ƽ��������Ӧ�����ƶ����Ӷ���������ˮLiCl���Ʊ�����2�֣�
��������һ�������£�0.1mol����A��0.1molNH4Cl����ǡ����ȫ��Ӧ�����ɹ���B��4.48L(��״��)����C������C��������ˮ�õ�������Һ������֪CΪNH3�������ˮB������һ�ֶ�����Ԫ�صĽ�������D��������BΪ����D���Ȼ��4.48L���������ʵ���=4.48L/22.4L/mol=0.2mol��������=0.2mol��17g/mol=3.4g��0.1mol����A������Ϊ2.30g��0.1molNH4Cl���������Ϊ5.35g�����������غ��֪B������Ϊ2.3g+5.35g-3.4g=4.25g�� A�к�Li����DΪ��A������������A��NH4Cl���巴Ӧ�ɱ�Ϊ��A+NH4Cl��LiCl+NH3������Clԭ���غ㣬LiCl�����ʵ���=0.1mol����ô2.3g������A�к�LiԪ��ҲΪ 0.1mol���ٸ��������غ��ԭ���غ㣨ԭ�ӵ��������Ŀ��Ӧǰ����ͬ������2.3gA�к���Nԭ��Ϊ0.2mol-0.1mol=0.1mol������Hԭ��Ϊ0.2mol��4-0.4mol=0.2mol������֪A��LiNH2��
��1��������������֪��AΪLiNH2��CΪ�����������ʽΪ ��
��
��2��������A��NH4Cl��Ӧ�Ļ�ѧ����ʽΪLiNH2��NH4Cl=LiCl��2NH3��
��3���ٽ���Li��Һ̬��N3H�����������·�Ӧ���Ʊ�LiNH2����ͬʱ�������������ʷ�ӦΪ�û���Ӧ��������LiNH2��ˮ����ˮ�⣬Ӧ������ӽ��ˮ������������������ӣ�NH2—���ˮ��������������ӣ���ˮ�ⷴӦ����ʽΪ��LiNH2��2H2O=LiOH��NH3����
��4���������̿�֪Ӧ�Ǵ���Һ�еõ����壬������в�������Ϊ����Ũ������ȴ�ᾧ������LiCl﹒H2O⇌LiCl+H2O��֪��������м�ѹ��Ŀ���Ǽ�Сѹǿ������������ƽ�����������ƶ�����������ˮLiCl���Ʊ���
��˼·�㲦�����⿼�������ƶϡ���ѧʵ��ȣ���Ŀ�زıȽ�İ����������Ŀ�Ѷȣ����ؿ���ѧ����֪ʶ��Ǩ��Ӧ�����ۺϷ������������������ѧ�����������нϸߵ�Ҫ����A�к�LiԪ�أ������DΪLi�ǹؼ����ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ڿ��淴ӦA(g)��2B(g)2C(g)(����ӦΪ���ȷ�Ӧ)������ͼ������ȷ����(����)

A����������������B.

C����������������D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й����л����˵���У��������(����)
A��CCl4����CH4�Ƶã�����ȡ��ˮ�еĵ�
B��ʯ�ͺ���Ȼ������Ҫ�ɷֶ���̼�⻯����
C���Ҵ�������������������ñ���Na2CO3��Һ����
D��������ʹ����KMnO4��Һ��ɫ����˱����ܷ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�����������������Ⱦ�������·�Ӧ��
CH4(g)��2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g) 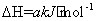
���¶�T1��T2ʱ���ֱ�0.50molCH4��1.2molNO2�������Ϊ1L�ĺ����ܱ������У����n��N2����ʱ��仯���������±���
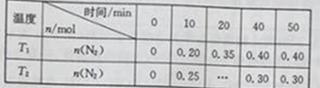
����˵������ȷ����
A. 10 min�ڣ�T1ʱ��v��N2����T2ʱ��С
min�ڣ�T1ʱ��v��N2����T2ʱ��С
B. T1<T2
C. a<0
D. T2ʱ������ƽ�����������ٳ���1.2molCH4�����´ﵽƽ��ʱn��N2��=0.40mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ȼ�ױ��ж��Ļ�ѧ���������װ��Ӧ����Σ�վ����ǩ���������������˱�ǩ����
| A | B | C |
| |
| ���ʵĻ�ѧʽ | ŨH2SO4 | CCl4 | P4 | NH4NO3 |
| Σ�վ����ǩ | ��ʴƷ | ��ȼƷ | �綾Ʒ | ��ըƷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£���2 L�����ܱ������г���1.0 mol A��1.0 mol B����Ӧ ����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ�������
����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±�������˵����ȷ���ǣ�������
| t��s | 0 | 5 | 15 | 25 | 35 |
| n(A)��mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A����Ӧ��ǰ5 s��ƽ������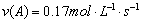
B�����������������䣬�����¶ȣ�ƽ��ʱ ����Ӧ��
����Ӧ��
C����ͬ�¶��£���ʼʱ�������г���2.0 mol C�ﵽƽ��ʱ��C��ת���ʴ���80��
D����ͬ�¶��£���ʼʱ�������г���0.20 mol A��0.20 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ4NH3��g��+5O2(g)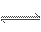 4NO(g)+6H2O (g)��10 L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45 mol����˷�Ӧ��ƽ������v(X)����Ӧ����������ʻ���������������ʣ��ɱ�ʾΪ�� ��
4NO(g)+6H2O (g)��10 L�ܱ������н��У�����Ӻ�ˮ���������ʵ���������0.45 mol����˷�Ӧ��ƽ������v(X)����Ӧ����������ʻ���������������ʣ��ɱ�ʾΪ�� ��
A.v(NH3)=0.010 mol��(L��s)-1 B.v(O2)=0.001 mol�� (L��s)-1
C.v(NO)=0.001 0 mol��(L��s)-1 D.v(H2O)=0.045 mol��(L��s)-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com