

���� 2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ۽��ͣ�ClԪ�صĻ��ϼ����ߣ��÷�Ӧת��10e-���������������Դ�����������������ԣ��Ҹõ�Ԫ������5mol����ת��10mol���ӣ��Դ������
��� �⣺��1��2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ���+7����Ϊ+2��KMnO4Ϊ��������ClԪ�صĻ��ϼ���-1����Ϊ0��ʧȥ���ӱ�������
�ʴ�Ϊ��KMnO4��Cl��
��2��KMnO4Ϊ��������Cl2Ϊ��������ɷ�Ӧ��֪����������������������ʵ���֮��Ϊ2��5���ʴ�Ϊ��2��5��
��3���������������Դ�����������������ԣ��������ԣ�KMnO4��Cl2���ʴ�Ϊ������
��4����Ӧ2KMnO4+16HCl��Ũ��=2KCl+2MnCl2+5Cl2��+8H2O�У�MnԪ�صĻ��ϼ���+7����Ϊ+2��KMnO4Ϊ���������õ��ĵ���Ϊ2����7-2��e-=10e-��ClԪ�صĻ��ϼ���-1����Ϊ0��HClΪ��ԭ����ʧȥ�ĵ���Ϊ5��2����1-0��e-=10e-��˫���ű����Ӧ�е��ӵ�ת�Ʒ������ĿΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��5��ÿ���ɱ�״����2.24L Cl2����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ$\frac{2.24L}{22.4L/mol}$��$\frac{10}{5}$=0.2mol���ʴ�Ϊ��0.2mol��
���� ���⿼��������ԭ��Ӧ�����㣬Ϊ��Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ������ط�������������Ŀ��飬ע������������������ת�Ƽ��㣬��Ŀ�ѶȲ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ư����Ư������ΪCa��ClO��2��һ��������������HClO | |
| B�� | ����������С�մ�ȿ���������θ����� | |
| C�� | �����ܹ�����ɱ���������˽���������� | |
| D�� | �������������������ά |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
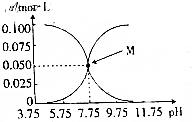 �����£���c��HCN��+c��CN-��=0.1mol•L-1�������ᡢ�軯�ƵĻ����Һ����Һ��c��HCN����c��CN-����pH�Ĺ�ϵ��ͼ��ʾ����������������ǣ�������
�����£���c��HCN��+c��CN-��=0.1mol•L-1�������ᡢ�軯�ƵĻ����Һ����Һ��c��HCN����c��CN-����pH�Ĺ�ϵ��ͼ��ʾ����������������ǣ�������| A�� | ��pH=8.75�ĸ���Һ�У�c��CN-����c��HCN����c��OH-����c��H+�� | |
| B�� | ��M������ʾ����Һ�У�c��Na+��+c��H+��=c��HCN��+c��OH-�� | |
| C�� | ����Һ�����ԡ����Ի�����ʱ��ʼ���У�c��Na+��+c��H+��+c��OH-��-c��HCN��=0.1mol•L-1 | |
| D�� | ����Һ�е�c��HCN��=c��CN-��ʱ���ε�ˮ��̶ȴ�����ĵ���̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��NaAlO2��Һ�е���NaHCO3��Һ�а�ɫ������ԭ���Ƕ��߿��Է���˫ˮ�ⷴӦ | |
| B�� | ��⾫��ͭʱ���������õ�1.204��1024�����ӣ���������������6.4g | |
| C�� | ʹ���ȱ��ɫ��Һ��Mg2+��K+��SO42-��NO3-�ܴ������� | |
| D�� | Na2S�ڿ����г��ڷ��ñ���ǵ����ӷ���ʽΪ��2S2-+O2+4H+=2S+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��Ӧ�� | I | II | III |
| �������x/mL | 0��x��10.0 | 10.0��x��40.0 | x��40.0 |
| �� �� | ������ | �������� | ������ |
| ���� | CO32-+H+=HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
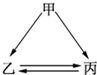 ��ͼ��ʾ�ļס��ҡ����������ʾ�������ͬ��ij��Ԫ�أ���ͷ��ʾ���ʼ��ת��һ������ʵ�֣�������ǣ�������
��ͼ��ʾ�ļס��ҡ����������ʾ�������ͬ��ij��Ԫ�أ���ͷ��ʾ���ʼ��ת��һ������ʵ�֣�������ǣ�������| A�� | �٢ڢۢ� | B�� | �ڢۢܢ� | C�� | �٢ڢۢ� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.0mol/L��KNO3��Һ��H+��Fe2+��SO42- | |
| B�� | ǿ������Һ��Na+��HCO3-��NO3-��SO42- | |
| C�� | ����̪������Һ�У�K+��Na+��NH4+��Br- | |
| D�� | ǿ������Һ��Na+��NH4+��SO42-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
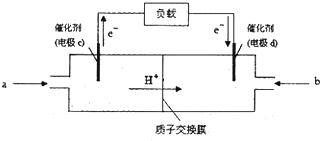
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮ | |
| B�� | �����ᴿ | |
| C�� | ��������ԭ����ͭ | |
| D�� | ���Ȼ��ƾ�������100mL0.1mol•L-1���Ȼ�����Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com