
在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
① 产生这些气体消耗的锌的质量是多少?② 通过导线的电子的物质的量是多少?
③ 原稀硫酸的物质的量浓度是多少?④ 若整个反应用时5分钟,则用H+表示该反应的平均速率为多少?
① 9.75 g;② 0.3 mol;③ 0.75 mol/L ④ 0.3 mol?L-1?min-1
【解析】
试题分析:①铜片、锌片和稀硫酸组成的原电池中,金属锌为负极,电极反应为:Zn-2e-=Zn2+。金属铜为正极,电极反应为:2H++2e-=H2↑,当在铜片上放出3.36L(标准状况)即0.15mol的H2时,转移电子为0.3mol,在负极消耗金属锌为0.15mol,质量为0.15mol×65g/mol=9.75g。
③氢气的物质的量是0.15mol,则根据氢原子守恒可知,200mL稀硫酸中硫酸的物质的量为0.15mol,乙醇稀硫酸的物质的量浓度c=0.15mol÷0.2L=0.75mol/L。
④反应速率通常用单位时间内浓度的变化量来表示,则用H+表示该反应的平均速率=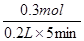 =0.3 mol?L-1?min-1。
=0.3 mol?L-1?min-1。
考点:考查原电池原理的有关判断、应用和计算
点评:该题是中等难度的试题,主要是考查学生对原电池原理的熟悉了解程度,有利于培养学生的规范答题能力。根据原电池的工作原理书写电极反应并根据电极反应进行计算是考试的热点,需要重点掌握并能灵活运用。


科目:高中化学 来源: 题型:
(6分)在由铜片、锌片和200 mL稀硫酸组成的原电池中,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)通过导线的电子的物质的量是 mol
(2)原稀硫酸的物质的量浓度是 mol/L
(3)产生这些气体消耗的锌的质量是 克 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
①求产生这些气体时消耗的锌的质量是多少克?
②通过导线的电子的物质的量?
③求原稀硫酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2012-2013年江苏南京学大教育专修学校高一3月月考化学试卷(带解析) 题型:计算题
在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的氢气时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质 量是多少?
(2)通过导线的电子的物质的量是多少?
(3)原稀硫酸的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江温州龙湾中学高一期中考试文科化学试卷(解析版) 题型:填空题
(6分)在由铜片、锌片和200 mL稀硫酸组成的原电池中,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)通过导线的电子的物质的量是 mol
(2)原稀硫酸的物质的量浓度是 mol/L
(3)产生这些气体消耗的锌的质量是 克 ;
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省慈溪市高三上学期期中考试化学试卷 题型:填空题
(6分)在由铜片、锌片和200 mL稀硫酸组成的原电池中,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)通过导线的电子的物质的量是 mol
(2)原稀硫酸的物质的量浓度是 mol/L
(3)产生这些气体消耗的锌的质量是 克 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com