
����Ŀ����ͼ������A��M��һ�������µ�ת����ϵ�����ֲ��P��Ӧ����δ�г��������У�I���ɵ�������Ԫ����ɵĵ������۵���ߵĽ�����K��һ�ֺ���ɫ���壮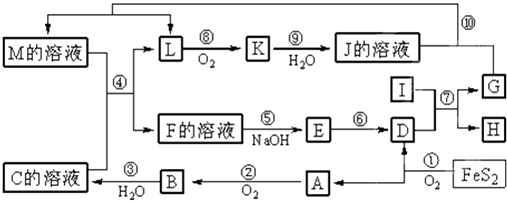
����д���пհף�
��1�������ڱ��У���ɵ���G��Ԫ��λ�ڵ������壮
��2���ڷ�Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ ��
��3���ڷ�Ӧ�ڡ��ۡ��ޡ����У������ڻ��Ϸ�Ӧ�����ڷ�������ԭ��Ӧ���� �� ����д��ţ�
��4����Ӧ�ܵ����ӷ���ʽ�ǣ� ��
��5����������D��KNO3��KOH���ڣ����Ƶ�һ�֡���ɫ��������Ч��ˮ��K2FeO4��������أ���ͬʱ������KNO2��H2O���÷�Ӧ�Ļ�ѧ����ʽ�ǣ� ��
���𰸡�
��1���ģ���
��2��1��2
��3����
��4��3Fe2++4H++NO3��=3Fe3++NO��+2H2O
��5��Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
���������⣺FeS2�����õ���A���Լ�������������AΪSO2 �� BΪSO3 �� CΪB��ˮ���CΪH2SO4 �� DΪFe2O3 �� IΪ���������۵���ߵĽ�����ӦΪAl����Ӧ��Ϊ��������������������������û���Ӧ�������ȷ�Ӧ��K��һ�ֺ���ɫ���壬ΪNO2 �� ��JΪHNO3 �� L��������ΪNO2 �� ��L����Ϊ����NO2 �� ����C��Һ����������Һ����ijM��Һ��Ӧ�õ�L����L�������Ǽ��Ե����就������LΪNO��G�������ᷴӦ���ܲ���NO����GΪFe��HΪAl2O3 �� �ɷ�Ӧ4FeS2+11O2 ![]() 2Fe2O3+8SO2 �� �����õ���A���Լ�������������AΪSO2 �� BΪSO3 �� CΪB��ˮ���CΪH2SO4 �� DΪFe2O3 �� ��K��һ�ֺ���ɫ���壬KΪNO2 �� JΪHNO3 �� IΪ���������۵���ߵĽ�����ӦΪAl����Ӧ��Ϊ��������������������������û���Ӧ��G�������ᷴӦ���ܲ���NO����GΪFe��HΪAl2O3 �� LΪNO��MӦΪFe��NO3��3��Fe��NO3��2����ϵ��Ӧ�ܣ�M+H2SO4 ��F+NO��֪��MΪFe��NO3��2 �� ��Ӧ���������ʣ�࣬FΪFe��NO3��3��Fe2��SO4��3 �� EӦΪFe��OH��3 �� ��1�������Ϸ�����֪GΪFe����26��Ԫ�أ�λ�����ڱ��������ڵڢ��壬���Դ��ǣ��ģ�������2����Ӧ��ΪAl��Fe2O3���������û���Ӧ������ʽΪ2Al+Fe2O3
2Fe2O3+8SO2 �� �����õ���A���Լ�������������AΪSO2 �� BΪSO3 �� CΪB��ˮ���CΪH2SO4 �� DΪFe2O3 �� ��K��һ�ֺ���ɫ���壬KΪNO2 �� JΪHNO3 �� IΪ���������۵���ߵĽ�����ӦΪAl����Ӧ��Ϊ��������������������������û���Ӧ��G�������ᷴӦ���ܲ���NO����GΪFe��HΪAl2O3 �� LΪNO��MӦΪFe��NO3��3��Fe��NO3��2����ϵ��Ӧ�ܣ�M+H2SO4 ��F+NO��֪��MΪFe��NO3��2 �� ��Ӧ���������ʣ�࣬FΪFe��NO3��3��Fe2��SO4��3 �� EӦΪFe��OH��3 �� ��1�������Ϸ�����֪GΪFe����26��Ԫ�أ�λ�����ڱ��������ڵڢ��壬���Դ��ǣ��ģ�������2����Ӧ��ΪAl��Fe2O3���������û���Ӧ������ʽΪ2Al+Fe2O3 ![]() 2Fe+Al2O3 �� �������������������ǻ�ԭ�����������뻹ԭ�������ʵ���֮��Ϊ1��2�����Դ��ǣ�1��2����3���ڷ�Ӧ�ڡ��ۡ��ޡ����У��ڡ��ޡ��ᶼΪ������ԭ��Ӧ����ΪSO3+H2O=H2SO4�ķ�Ӧ�������ڻ��Ϸ�Ӧ�����ڷ�������ԭ��Ӧ�����Դ��ǣ��ۣ���4��M�к���Fe2+��NO3�� �� �����������¿ɷ���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3��=3Fe3++NO��+2H2O�����Դ��ǣ�3Fe2++4H++NO3��=3Fe3++NO��+2H2O����5��������Fe2O3��KNO3��KOH���ڣ����Ƶ�һ�֡���ɫ��������Ч��ˮ��K2FeO4��������أ���ͬʱ������KNO2��H2O����Ӧ����ʽΪFe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O�����Դ��ǣ�Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O��
2Fe+Al2O3 �� �������������������ǻ�ԭ�����������뻹ԭ�������ʵ���֮��Ϊ1��2�����Դ��ǣ�1��2����3���ڷ�Ӧ�ڡ��ۡ��ޡ����У��ڡ��ޡ��ᶼΪ������ԭ��Ӧ����ΪSO3+H2O=H2SO4�ķ�Ӧ�������ڻ��Ϸ�Ӧ�����ڷ�������ԭ��Ӧ�����Դ��ǣ��ۣ���4��M�к���Fe2+��NO3�� �� �����������¿ɷ���������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ3Fe2++4H++NO3��=3Fe3++NO��+2H2O�����Դ��ǣ�3Fe2++4H++NO3��=3Fe3++NO��+2H2O����5��������Fe2O3��KNO3��KOH���ڣ����Ƶ�һ�֡���ɫ��������Ч��ˮ��K2FeO4��������أ���ͬʱ������KNO2��H2O����Ӧ����ʽΪFe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O�����Դ��ǣ�Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O��


 �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�����������ǣ� ��
A. ��Һʱ����Һ©���²�Һ����¿ڷų����ϲ�Һ����Ͽڵ���
B. ����ʱ��Ӧʹ�¶ȼ�ˮ����������ƿ֧�ܿڴ�
C. �����ᾧʱ��Ӧ����Һ����
D. ����ʱ��Ӧ�����������������ƽ�����̣��������������ƽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ����Һ�д���Ca2+��Mg2+��SO42-�����ʣ�����ʱ����NaOH��Na2CO3��BaCl2�����ᣬ���������Լ�˳����ȷ����
��NaOH BaCl2Na2CO3HCl ��BaCl2HCl NaOH Na2CO3
��Na2CO3BaCl2NaOH HCl ��BaCl2 NaOH Na2CO3HCl
A. �٢�B. �٢�C. �ۢ�D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����BaSO4�����������ⶨ��Ʒ��SO42-�ĺ���ʱ��������Һ�������������������ֽ��δ���ѣ���ʱ��Ӧ�ã� ��
A.����Һ����©�����¹���
B.��©�����ټ�һ����ֽ������Һ���¹���
C.��ȡһ©��������Һ���˺���ԭ��ֽ�ϲ�
D.��ȥ������ȡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ��CuCl2��Һ��װ�ã�����c��dΪʯī�缫���������й��ж���ȷ���ǣ� �� 
A.a������b����
B.d������c����
C.�������У�d�缫��������
D.�������У�������Ũ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������![]() ��ʾԭ�ӣ�
��ʾԭ�ӣ�
��1������ԭ�ӵ���������N��______��
��2�������ӵ���������AXn������x�����ӣ���N��______��
��3�����Է�����������12C16O2�����У�N��______��
��4��A2��ԭ�Ӻ�����x�����ӣ���������Ϊm����n g A2���������ӵ����ʵ���Ϊ____ mol��
������![]() ��
��![]() ��
��![]() ����H2��D2��T2����ʯī�����ʯ����
����H2��D2��T2����ʯī�����ʯ����![]() ��
��![]() ��
��![]() �����������ʣ��ش��������⣺
�����������ʣ��ش��������⣺
��1����Ϊͬλ�ص���________(���ţ���ͬ)��
��2����Ϊͬ�����������________��
��3���Тٺܵ͢��������______����Է���������ͬ����ԭ�ӻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �ڱ�״���£�NA���κη�����ռ�����ԼΪ22.4L
B. 6.02��1023�������Ӻ�6.02��1023������ӵ������ȵ���14:l
C. �ڱ�״���£�������Ϊ28g��N2��CO�Ļ�����壬�����ԼΪ22.4L
D. �����Ħ����������g/molΪ��λ����6.02��1023��������ӵ���������gΪ��λ������ֵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������г�����һЩ��̬ԭ�ӵ�2p�����3d����е����Ų��������Υ�����ع�����У� �� 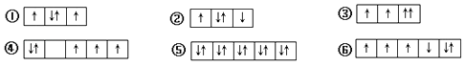
A.�٢ڢ�
B.�ܢݢ�
C.�ڢܢ�
D.�ۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����б仯ʱ����Ҫ�˷���ͬ��������������
A.ˮ���ɱ����ۻ�B.ʳ�κʹ����Ƶ��ۻ�
C.Һ���Һ��������D.HCl��NaCl����ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com