
【题目】中和相同体积,相同pH的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系式为
A. V3>V2>V1 B. V3=V2>V1
C. V1=V2>V3 D. V3>V2=V1
科目:高中化学 来源: 题型:
【题目】第三周期的元素单质及其化合物有广泛的用途,请根据相关知识回答下列问题:
(1)原子最外层电子数是核外电子总数![]() 的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
的元素,其原子结构示意图为________________;还原性最弱的简单阴离子__________ (填离子符号)。
(2)晶体硅(熔点1410℃)是良好的半导体材料,可通过如图所示过程制备:
![]()
在上述由SiCl4制纯硅的反应中, 测得每生成2.8kg纯硅需要吸收akJ热量,请写出该反应的热化学方程式___________________。
(3)氯化铝的水溶液可用于净水,其原因是_________ (用离子方程式表示)。
工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)来制取无水氯化铝的一种工艺流程如图所示:
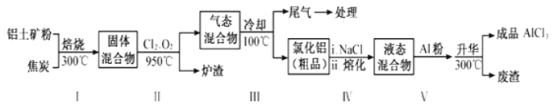
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 | Al2O3 | Fe2O3 | SiO2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 | 2980 | 3414 | 2230 |
①工业制铝时,电解Al2O3而不电解AlCl3的理由是____________。
② 步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多, 其作用是_________ (只要求写出一种)。
③步骤Ⅱ中若不通入氯气和氧气,则生成相对原子质量比硅大的单质______________。
④尾气经冷却至室温后用足量的KOH浓溶液吸收,生成的盐中除了K2CO3外,还有3种,其化学式分别为________________;其中一种盐可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:________________。
⑤结合流程及相关数据分析,步骤V中加入铝粉的目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种常见的强氧化剂,能氧化硫酸亚铁、盐酸等物质。某兴趣小组模拟企业处理含铬废水(主要含Cr2O72-和Cr3+),同时获得重铬酸钾晶体的流程如下:
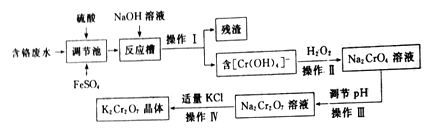
回答下列问题:
(1)操作I是______,残渣的主要成分是______。
(2)调节池中发生的主要反应的离子方程式为__________________。
(3)操作Ⅲ__________(填“能”或“不能”)用盐酸调节溶液pH,原因是___________。
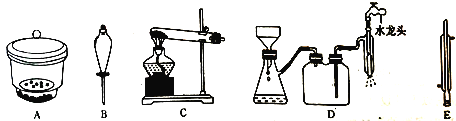
(4)从Na2Cr2O7溶液中获得K2Cr2O7晶体的操作依次是加入适量KCl固体,搅拌、溶解,在水浴上加热浓缩至________时停止加热。接下来获得K2Cr2O7晶体需要的一系列操作中,下列仪器可能会用到的是__________(填标号)。
(5)为检测处理后废水是否达到排放标准,某同学进行了如下实验:取100mL处理后的废液样品于锥形瓶中,用浓醋酸调节pH=5并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr2+,再用cmol· L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr3++Y4-=CrY-,若实验消耗EDTA标准溶液VmL,则处理后的废液中含铬元素浓度为______mg·L-1(用含c、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护自然环境,提高人民的生活质量,必须重视处理“白色污染”。该“白色污染”指的是( )
A. 冶炼厂的白色烟尘B. 石灰窑的白色粉末
C. 聚氯乙烯等塑料垃圾D. 白色建筑材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用480mL、0.5mol/L的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)实验需要的玻璃仪器除了烧杯、胶头滴管、量筒、玻璃棒,还有__________________
(2)计算:98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为______,配制本次实验需要的稀硫酸需用量筒量取上述98%的浓H2SO4___________________ mL
(3)配制过程:①用量筒量取所需的浓硫酸
②将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
③用玻璃棒引流将烧杯中的溶液转移到已经检漏的合适规格的容量瓶中
④洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀
⑤向容量瓶中加入蒸馏水,在距离刻度1~2cm时,改用胶头滴管加蒸馏水至刻度线
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦将配制好的溶液转移至试剂瓶中待用。
上述配置溶液的步骤存在缺失,缺少的步骤是_____________________,应放在步骤_____之前进行(填“序号”)。
(4)在横线上填写下列各种情况对所配制溶液浓度的影响(选填“偏高”、“偏低”或“无影响”).
①所用的浓硫酸长时间放置在密封不好的容器中______
②量取浓硫酸所用量筒有蒸馏水______
③定容时,俯视液面______.
④用量筒量取浓硫酸时仰视液面________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,可以制备一系列物质(见下图),下列说法正确的是( )

A. NH4Cl和NaHCO3都是常用的化肥
B. NH4Cl、HNO3和Na2CO3受热时都易分解
C. NH3和NO2在一定条件下可发生氧化还原反应
D. 图中所涉及的盐类物质均可与Ca(OH)2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱琉可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是___________________,氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是_________________。
(2)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:

①“吸收装置”中发生反应的离子方程式_____________________。
②上述流程中循环利用的物质是____________________。
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。

①通入空气吹出Br2,并用Na2CO3吸收的目的是______________________;
②反应③中每生成3molBr2,转移电子的物质的量为__________mol;
③为了除去工业Br2中微量的C12,可向工业Br2中_____________(填字母)。
a.通入HBr b.加入NaBr溶液
c.加入Na2CO3溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、 Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁:
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是__________________;
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_____________(填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com