
下列反应中Na2O2,只表现强氧化性的是
A.2Na2O2+2H2O=4NaOH+O2↑
B.Na2O2+MnO2=Na2MnO4
C.2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑
D.5Na2O2+2KMnO4+8H2SO4=5Na2SO4+K2SO4+2MnSO4+8H2O+5O2↑
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:2016届山东省烟台市高三上学期期中测试化学试卷(解析版) 题型:选择题
钛是二十一世纪的“明星金属”。工业制钛以金红石为原料,发生的反应是:

关于反应I、Ⅱ的下列说法中正确的是
A.反应I中的TiO2是氧化剂
B.TiCl4在反应I中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应I、Ⅱ中共转移0.8 mol电子
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期半期考试化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,以下说法正确的是
A.在通常条件下,1mol氩气含有的原子数为2NA
B.56g金属铁由原子变为离子时失去的电子数为NA
C.在标准状况下,2.24 L氨气所含的电子总数约为NA
D.1 mol/L 的 Na2SO4溶液中含有Na+个数为2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨附属中学高二上期中化学试卷(解析版) 题型:选择题
一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2 + 3H2  2NH3,2min时测得剩余N2为1mol,此时化学反应速率表示不正确的是
2NH3,2min时测得剩余N2为1mol,此时化学反应速率表示不正确的是
A.υ(N2) = 0.25mol/(L·min) B.υ(H2) = 0.75mol/(L·min)
C.υ(NH3) = 1mol/(L·min) D.υ(NH3) = 0.5mol/(L·min)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上期中测试化学试卷(解析版) 题型:选择题
若20 g密度为ρ g·cm-3的硝酸钙溶液里含1 g Ca2+,则NO3-的物质的量浓度是
A.2.5ρ mol·L-1 B. mol·L-1 C.
mol·L-1 C. mol·L-1 D.1.25ρ mol·L-1
mol·L-1 D.1.25ρ mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期期中测试化学试卷(解析版) 题型:选择题
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图:饱和食盐水溶液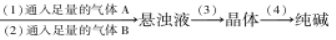
则相关的说法错误的是
A.通入的气体:A是CO2,B是NH3
B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小
C.步骤(3)的操作为过滤,滤液可作化学肥料
D.步骤(4)中,将晶体加热分解可以得到纯碱
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。

请填写下列空白:
(1)图中试剂1是________,试剂2是________。试剂4最好是________。
(2)步骤1和步骤2所用到的玻璃仪器是________________。
(3)步骤1反应的离子方程式为________________________。
(4)步骤5反应的离子方程式为________________________。
(5)Al(OH)3可用 以下三种途径制备
以下三种途径制备
①Al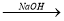 NaAlO2
NaAlO2 Al(OH)3 ②Al
Al(OH)3 ②Al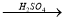 Al2(SO4)3
Al2(SO4)3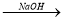 Al(OH)3
Al(OH)3
③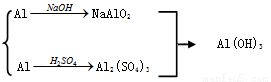
上述三途径制备Al(OH)3你认为最佳途径是 ,理由是 。
查看答案和解析>>
科目:高中化学 来源:2016届河南省顶级名校高三上学期期中测试化学试卷(解析版) 题型:选择题
下列有关NaClO和NaCl混合溶液的叙述正确的是
A.该溶液中,H+、NH4+、SO42-、Br-可以大量共存
B.该溶液中,Ag+、K+、NO3-、CH3CHO不能大量共存
C.向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+=== Cl-+2Fe3++H2O
D.向该溶液中加入浓盐酸,每产生22.4LCl2,转移电子约为6.02×1023个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com