
����Ŀ����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��100 g 5.00%��NaOH��Һ��������CuSO4��Һ��100 g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��
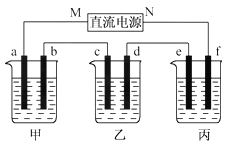
(1)��ͨ��Դ������һ��ʱ���ñ���K2SO4Ũ��Ϊ10.47%������c�缫�������ӡ��ݴ˻ش����⣺
�ٵ�Դ��N��Ϊ____________����
�ڵ缫b�Ϸ����ĵ缫��ӦΪ____________________��
����ʽ����缫b�����ɵ������ڱ�״���µ������________________��
�ܵ缫c�������仯��__________g��
�ݵ��ǰ�����Һ���ᡢ���Դ�С�Ƿ����仯��������ԭ��
����Һ__________________������Һ___________________������Һ______________��
(2)�����������ͭȫ����������ʱ����ܷ�������У�Ϊʲô�� _____________________��
���𰸡���4OH����4e��===2H2O��O2��2.8L16����Һ����������Ϊ����ˮ�����٣���Һ��NaOHŨ����������Һ����������Ϊ������OH������O2����Һ��H������Ũ�����ӱ���Һ����Դ�Сû�б仯����ΪK2SO4��ǿ��ǿ���Σ�Ũ�����Ӳ�Ӱ����Һ��������ܼ������У���ΪCuSO4��Һ��ת��ΪH2SO4��Һ����ӦҲ�ͱ�Ϊˮ�ĵ�ⷴӦ��
��������������������⿼����ԭ����Ӧ�ã���Ŀ�Ѷ��еȡ���ϵ��ԭ��ȷ�жϵ��ص�������д���缫��Ӧʽ���з�����
��1������������֪����c�缫�������ӣ�˵��Cu������c�缫�ϣ��缫��ӦΪCu2++2e-=Cu��������ԭ��Ӧ��Ϊ���ص����������Դ��M���Ǹ�����N��Ϊ������������Ϊ���NaOH��Һ���൱�ڵ��H2O������b��Ϊ������OH-�ŵ磬�缫��ӦΪ4OH--4e-=2H2O+O2����������Ϊ���K2SO4��Һ���൱�ڵ��ˮ�������ˮ������Ϊx���ɵ��ǰ��������������У�100��10%=��100-x����10.47%����x=4.5g�����ʵ���Ϊ0.25mol���ɷ���ʽ2H2O![]() 2H2��+O2����֪����O2Ϊ0.125mol��ת�Ƶ��ӵ����ʵ���Ϊ0.5mol�����������ڱ���µ����Ϊ0.125mol��22.4L/mol=2.8L����������·�Ǵ����ģ�����ÿ���ձ��еĵ缫��ת�Ƶ���������ȵģ����ݵ缫��Ӧ��Cu2++2e-=Cu֪ת��0.5mol�������ɵ�n��Cu��=0.25mol������Ϊ16g���������൱�ڵ��ˮ����NaOH��Ũ������pH�����������ΪCu2+�ŵ磬����ΪOH-�ŵ磬��ⷽ��ʽΪ��2CuSO4+2H2O
2H2��+O2����֪����O2Ϊ0.125mol��ת�Ƶ��ӵ����ʵ���Ϊ0.5mol�����������ڱ���µ����Ϊ0.125mol��22.4L/mol=2.8L����������·�Ǵ����ģ�����ÿ���ձ��еĵ缫��ת�Ƶ���������ȵģ����ݵ缫��Ӧ��Cu2++2e-=Cu֪ת��0.5mol�������ɵ�n��Cu��=0.25mol������Ϊ16g���������൱�ڵ��ˮ����NaOH��Ũ������pH�����������ΪCu2+�ŵ磬����ΪOH-�ŵ磬��ⷽ��ʽΪ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4������H+���࣬��pH��С������Ϊ���ˮ������K2SO4���ԣ���pH�������䡣
2Cu+O2��+2H2SO4������H+���࣬��pH��С������Ϊ���ˮ������K2SO4���ԣ���pH�������䡣
��2����ͭȫ������ʱ����ҺΪϡ���ᣬ���Լ�����⡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ���������ʽ��з��࣬MgO����
A. ������ B. �� C. �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ũ�����˵����ȷ����
A. �ѻӷ� B. ����ˮ��
C. ��������ʹ��Ƭ�ۻ� D. ��������ɫ�Լ�ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����������ǿ��淴ӦA(g)+3B(g)![]() 2C(g)�ڶ����ܱ������дﵽƽ��ı�־����
2C(g)�ڶ����ܱ������дﵽƽ��ı�־����
��C������������C�ķֽ�������ȣ�
����λʱ����amol A���ɣ�ͬʱ����3amol B��
��A��B��C��Ũ�Ȳ��ٱ仯��
������������ѹǿ���ٱ仯��
����������ƽ��Ħ���������ٱ仯��
����A��B��C�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1:3:2��
��A��B��C�ķ�����Ŀ��Ϊ1:3:2��
�����������ܶȲ��ٱ仯��
A. �ڢ� B. �٢ۢܢ� C. �ڢޢߢ� D. �ݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3 (g) +5O2(g)![]() 4NO(g) +6H2O(g)�� ��H=-a kJmol-1����5L�ܱ�����Ͷ��1molNH3��1mol��O2��2���Ӻ�NO�����ʵ���������0.4mol������˵����ȷ����
4NO(g) +6H2O(g)�� ��H=-a kJmol-1����5L�ܱ�����Ͷ��1molNH3��1mol��O2��2���Ӻ�NO�����ʵ���������0.4mol������˵����ȷ����
A. 2���ӷ�Ӧ�ų�����.��ֵС��0.1akJ
B. ��������ʾ2���ӵķ�Ӧ���ʣ�v(O2)=0.05mol ��L-1 ��min-1
C. 2������NH3��ת������50��
D. 2����ĩ c(H2O)=0.6mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��Dԭ�������������ӡ�X��Y��Z��W����������Ԫ���е�������ɳ����Ļ����YΪ����ɫ���壬��Ϊ���嵥�ʣ���Ϊ����ɫ���壬��������֮���ת����ϵ����ͼ��ʾ�����ַ�Ӧ���������ʡ�ԣ���������˵����ȷ����
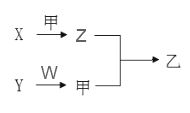
A. ԭ�Ӱ뾶:D>C>B>A
B. C��D���⻯���Ϊ���ۻ�����
C. ͼʾת����ϵ�漰�ķ�Ӧ��Ϊ������ԭ��Ӧ
D. �����̬�⻯����ȶ��ԣ�B>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һ��ȼ�ϵ�أ�����ȼ��ΪH2�Ϳ����������Ϊ���ڵ�K2CO3���ش���������
��CO![]() ����____________����
����____________����
��������ӦʽΪ____________________��
�۵����CO![]() �����ʵ�������________________���������١����䣩��
�����ʵ�������________________���������١����䣩��
��2��������ĵ�ض������ʽ��е�⣬����a��b��c��d��e��f�缫��Ϊ���Ե缫��ͨ���a���������������Զ���b����2���Ӻ���ҳص�pHΪ12����
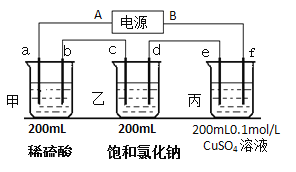
�ٵ�ԴA����______________����
��c���ϵĵ缫��Ӧʽ��___________________��
�ۼס������ع����ռ���________mol���塣
�ܱ�װ����ij������������________�ˣ���Һ��pHΪ________________�������£���������Һ����仯��
�ݵ��n���Ӻ�����ͭ���������꣬�ٽ�e��f�缫���ӵ�Դ����ͬ���ĵ����ٵ��n���ӣ������Һ�е�����ͭ�����ʵ���Ũ��Ϊ______________mol/L������������Һ����仯��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 m L 0.1mol/L Na2S ��Һ����μ���50 mL 0.1mol/L KHSO4��Һ��������Һ������Ũ�ȹ�ϵ��ȷ����
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com