
【题目】氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。用氧化还原观点分析,这“另一物质”在反应中作
A.氧化剂B.还原剂
C.氧化产物D.还原产物
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 在气体单质分子中,一定含有σ键,可能含有π键
B. 烯烃比烷烃的化学性质活泼是由于烷烃中只含σ键而烯烃含有π键
C. 等电子体结构相似,化学性质相同
D. 共价键的方向性决定了原子在形成分子时相互结合的数量关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中不正确的是 ( )
A. CS2为直线形的非极性分子
B. ClO3-的立体构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要减轻大气污染,必须加强对工业废气和汽车尾气等的治理.根据所学知识回答下列问题:
(1)控制燃煤产生的SO2排放,能够减少型酸雨的形成.燃煤排放的烟气中还古有其他大气污染物,请列举两种: .
(2)煤的气化和液化是实现能源清洁化的重要途径.将焦炭在高温下与水蒸气反应,得到CO和H2 , 就是煤的气化过程,该反应的化学方程式为 .
(3)在汽车尾气排放口加装“三效催化净化器”,在催化剂的作用下,可将尾气中的CO、NO转化为空气中的两种无毒气体,该反应的化学方程式为 .
(4)室内空气污染物包括CO、C02、甲醛、苯等,在这四种污染物中,由家用燃料燃烧产生的是;由建筑和装修产生的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
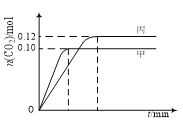
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。

(1)仪器A的名称是_____________;加入搅拌磁子的目的是防止暴沸和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作: 向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据键能数据(H—Cl 431 kJ/mol,H—I 297 kJ/mol),可得出的结论是 ( )
A. 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸
B. HI比HCl熔、沸点高
C. HI比HCl稳定
D. 拆开等物质的量的HI和HCl,HI消耗的能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第_____周期,_____族;
(2)比较X与Y的气态氢化物的稳定性:_____(写化学式);
(3)XW2的电子式为_____;
(4)比较X、Y、Z、W四种原子半径由大到小关系:_____;
(5)X和W形成的化合物属于_____ (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是

A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com