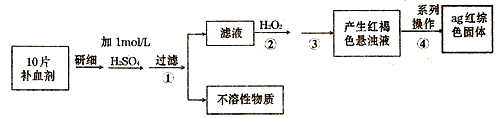
目前,我国西南三省正遭遇百年未遇的干旱,对于淡水资源的开源节流显得前所未有的迫切.日常生活中我们选用不同的物质对水资源进行处理.
(1)明矾(KAl(SO
4)
2.12H
2O)是我们生活中最广泛使用的净水剂,用离子方程式表示明矾净水的原理:
Al3++3H2O?Al(OH)3+3H+
Al3++3H2O?Al(OH)3+3H+
;写出明矾溶液中的电荷守恒是
c(K+)+3c(Al3+)+C(H+)=2c(SO42-)+c(OH-)
c(K+)+3c(Al3+)+C(H+)=2c(SO42-)+c(OH-)
.
(2)Cl
2常用作消毒剂是因为它能与水作用生成HClO,写出其离子方程式:
Cl2+H2O?H++Cl-+HClO
Cl2+H2O?H++Cl-+HClO
;在氯水中加入碳酸钙可以使得消毒效果更好,用化学平衡原理简述其原因:
加入的碳酸钙与H+发生反应,促进平衡正向移动,使得HClO的浓度增大,从而消毒效果更好
加入的碳酸钙与H+发生反应,促进平衡正向移动,使得HClO的浓度增大,从而消毒效果更好
.
(3)用铁酸钠(Na
2FeO
4)对来自江河湖泊的淡水消毒净化是城市饮用水处理的新技术,铁酸钠可用Fe(NO
3)
3、NaOH和Cl
2在一定条件下制得,写出该化学反应方程式:
2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O
2Fe(NO3)3+16NaOH+3Cl2=2Na2FeO4+6NaNO3+6NaCl+8H2O
.
(4)ClO
2是一种消毒杀菌效率高、二次污染小的水处理剂.ClO
2常采用电解饱和食盐水的方法制备,写出阳极反应方程式:
Cl--5e-+2H2O=ClO2+4H+
Cl--5e-+2H2O=ClO2+4H+
.




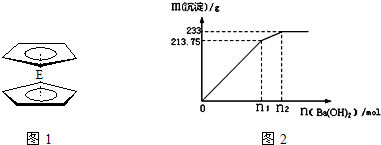
 .核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
.核磁共振法能够区分这两种结构.在核磁共振氢谱中,正确的结构有
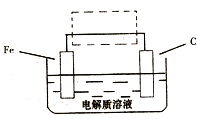 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题: