
【题目】下列离子方程式书写正确的是
A.向NH4HSO4溶液中滴加NaOH溶液至水的电离程度最大:2OH-+NH4++H+=NH3·H2O+H2O
B.硫酸型酸雨久置,pH减小:![]()
C.将Cl2通入少量FeBr2溶液中:2Fe2++Cl2=2Fe3++2Cl-
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合:![]() +7H++H2O=3Al(OH)3↓+Al3+
+7H++H2O=3Al(OH)3↓+Al3+
【答案】D
【解析】
A.铵根的水解促进水的电离,硫酸氢根电离出的氢离子抑制水的电离,所以水的的电离程度最大时溶液中的溶质为(NH4)2SO4,离子方程式为OH-+H+=H2O,故A错误;
B.由于亚硫酸被空气中氧气氧化成硫酸,导致酸雨久置pH变小,亚硫酸为弱酸,所以离子方程式为:2H2SO3+O2=4H++2![]() ,故B错误;
,故B错误;
C.将Cl2通入少量FeBr2溶液中,此时氯气过量,会将Fe2+和Br-全部氧化,离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.4mol·L-1的NaAlO2溶液和7mol·L-1的盐酸等体积混合有足量的氢离子将偏铝酸根和氢离子反应生成氢氧化铝沉淀溶解,离子方程式为4![]() +7H++H2O=3Al(OH)3↓+Al3+,故D正确;
+7H++H2O=3Al(OH)3↓+Al3+,故D正确;
综上所述答案为D。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如图:
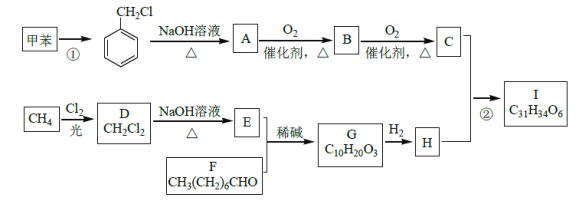
已知:a.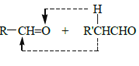
![]()
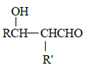
b.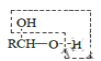
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是___;F的化学名称为___。
(2)②的反应类型是___;A→B的化学方程式为____。
(3)G的结构简式为____;H中所含官能团的名称是___。
(4)化合物W的相对分子质量比化合物C大14,且满足下列条件,W的可能结构有___种。其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W的结构简式___。
①遇FeCl3溶液显紫色②属于芳香族化合物③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备 的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选___(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示或根据图示所得出的结论正确的是
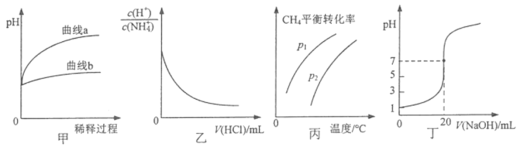
A.图甲表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
B.图乙表示温度不变,向0.1mol·L-1NH4Cl溶液中滴加0.1mol·L-1盐酸时,溶液中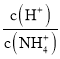 随盐酸体积的变化关系
随盐酸体积的变化关系
C.图丙表示密闭容器中CH4(g)+ H2O(g)CO(g)+3H2(g)到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P1<P2
D.图丁表示0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1醋酸溶液滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________.
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______(填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。
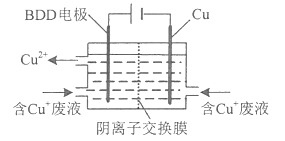
第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________(填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式) 。
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________.
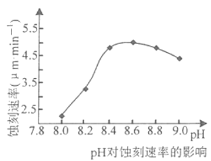
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N是原子序数依次增大的五种短周期主族元索,它们能形成一种有机酸(结构如图),五种元素原子的最外层电子数之和为24,Z和N同主族,M是非金属性最强的元素,下列说法错误的是
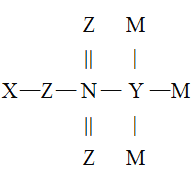
A.最高正化合价:N>Y>X
B.Z、N可分别与X形成等电子数的化合物
C.原子半径:N>Z>Y>M>X
D.Y和N均存在某种含氧酸能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院上海有机化学研究所有机氟化学重点实验室在寻找新的![]() 反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物
反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物![]() (氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(1)基态硫的价电子排布为_________________,氟的最高能级中电子云的形状为_______________.
(2)![]() 中四种元素的第一电离能由大到小的顺序为___________________.
中四种元素的第一电离能由大到小的顺序为___________________.
(3)以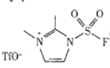 和NaN3为原料在一定条件下可合成
和NaN3为原料在一定条件下可合成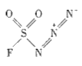 (氟磺酰基叠氮).
(氟磺酰基叠氮).
①NaN3中阴离子的中心氮原子的杂化方式为__________________.
② 中不存在_______________(填字母).
中不存在_______________(填字母).
A.极性键B.非极性键C.离子键D.金属键E.σ键F.π键
(4)H-S-C≡N和H-N=C=S均为叠氮酸(HN3)的等电子体,二者的沸点: H-S-C≡N<H-N=C=S,其原因是_________________,H-S-C≡N、H-N=C=S晶体中,有一种采用分子密堆积,即配位数为12,该物质是_____________________(填结构式).
(5)NaN3晶体的晶胞结构如图所示.
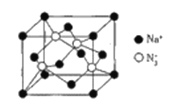
①晶体中,每个Na+周围与它距离最近且相等的Na+共有_____________个
②设阿伏加德罗常数的值为NA,晶胞参数为apm,则NaN3晶体的密度为_____________g·cm-3(列出计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl –
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.![]() 的溶液中: K+、NH
的溶液中: K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中: Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com