
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
【答案】D
【解析】
可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析。
①随着反应的进行,单位时间内消耗2 mol SO2的同时一定生成2 mol SO3,与反应是否达到平衡状态无关,故①不能说明达到平衡状态;②平衡时接触室中SO2、O2、SO3物质的量之比可能为2:1:2,可能不是2:1:2,与二氧化硫的转化率有关,故②无法说明达到平衡状态;③反应混合物中,SO3的质量分数不再改变,说明SO3的质量不再随时间变化而变化,此时反应达到平衡状态,故③能说明达到平衡状态;故答案为D。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法不正确的是
A.1molNa变成Na+时失去的电子数为NA
B.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
C.0.5molH2O中所含的氢原子数目为NA
D.1molH2中所含的质子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器内发生反应N2(g)+3H2(g)![]() 2NH3(g),不可能为平衡状态的是( )
2NH3(g),不可能为平衡状态的是( )
A. NH3、N2、H2的物质的量都不再改变
B. NH3、N2、H2的体积分数都不再改变
C. 混合气体平均相对分子质量不再改变
D. 一个N≡N断裂的同时,有3个H—H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol某金属单质与足量的盐酸反应,放出67.2L H2(标准状况),并转变为具有Ne原子电子层结构的离子,该金属元素在元素周期表中的位置是
A. 第三周期第ⅠA族B. 第三周期第ⅡA族
C. 第三周期第ⅢA族D. 第四周期第ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知氨基酸可发生如下反应:
![]()
D、E的相对分子质量分别为162和144,可发生如下物质转化关系。如下图所示:

(1)写出B、D的结构简式:B________,D_________。
(2)写出C→E的化学方程式:_________________。
(3)写出C→D的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如下图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后,观察到电流计指针向右偏转。下列判断不正确的是( )。
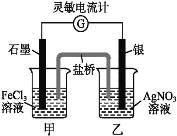
A. 在外电路中,电子从银电极流向石墨电极
B. 盐桥中的K+移向甲烧杯
C. 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
D. 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质反应后,再滴入KSCN溶液,显红色的是( )
A.过量铁与稀盐酸B.过量氯水与FeCl2溶液
C.过量铁粉与CuCl2溶液D.过量铁粉与FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com