
【题目】下列实验装置能达到相应实验目的的是
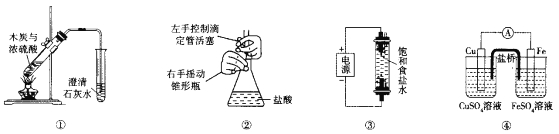
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:H2S:Ka1=1.3×10-7 Ka2=7.1×10-16 ,H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11, CH3COOH:Ka=1.8×10-5,HClO2:Ka=1.1×10-2,NH3·H2O:Kb=1.8×10-5。
(1)①常温下,0.1 mol·L-1Na2S溶液和0.1 mol·L-1Na2CO3溶液,碱性更强的是_____,其原因是_______。
②25 ℃时,CH3COONH4溶液显__性。NaHCO3溶液的pH___CH3COONa溶液的pH。
③NH4HCO3溶液显__性,原因是_________。
(2)能证明Na2SO3溶液中存在SO32-+H2OHSO3—+OH-水解平衡的事实是___。
A.滴入酚酞溶液变红,再加H2SO4溶液红色褪去
B.滴入酚酞溶液变红,再加BaCl2溶液后产生沉淀且红色褪去
C.滴入酚酞溶液变红,再加氯水后红色褪去
(3)25 ℃时,浓度均为0.1 mol·L-1的NaClO2溶液和CH3COONa溶液,两溶液中c(ClO2—)___c(CH3COO-)。若要使两溶液的pH相等应___。
a.向NaClO2溶液中加适量水 b.向NaClO2溶液中加适量NaOH
c.向CH3COONa溶液中加CH3COONa固体 d.向CH3COONa溶液中加适量的水
(4)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是_______(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸锰(MnTiO3)纳米材料是一种多用途催化剂。工业上用红钛锰矿(主要成分有MnTiO3,还含有少量FeO、Fe2O3、SiO2等杂质)来制备MnTiO3,其工艺流程如图所示:
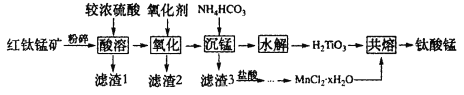
已知①红钛锰矿“酸溶”后Ti元素主要以TiO2+的形式存在;
②H2TiO3不溶于无机酸和碱,不溶于水;
③在空气中加热无水MnCl2分解放出HCl,生成Mn3O4。
回答下列问题:
(1)“粉碎”的目的是__。
(2)“酸溶”中发生的主要反应化学方程式为__。
(3)为了更好地把滤渣2分离出来,除搅拌外,还需要(填操作名称)___。
(4)“氧化”的氧化剂选用的是高锰酸钾,而不选择通常人们认可的绿色氧化剂“双氧水”,除了高锰酸钾氧化性强、反应快之外,还可能的原因是__(写出一条即可)。
(5)“沉锰”的条件一般控制在45℃以下的原因是__。
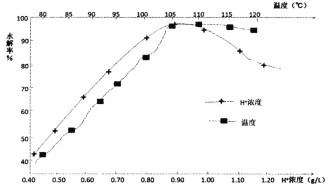
(6)TiO2+的水解率受温度和H+浓度的影响如图所示,TiO2+最适宜的水解条件是__。
(7)测定所得MnCl2·xH2O晶体中结晶水的含量。取29.70g样品加热分解,热重曲线(TG)如图所示。
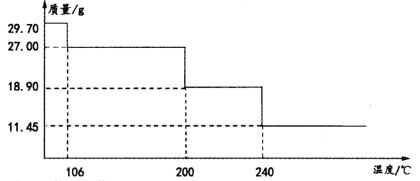
所得氯化锰晶体x的值是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、COx的消除和再利用对改善生态环境、构建生态文明具有重要的意义。
Ⅰ.反应N2(g)+O2(g)=2NO(g)△H1=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定条件下可发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g)△H2。
(1)已知CO的燃烧热为283.0kJ·mol-1,则△H2=___。
(2)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 和
和![]() 分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
分别表示O2、NO、N2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸过程中的能量状态最低的是__(填字母序号)。
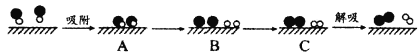
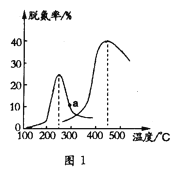
(3)另一研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内脱氮率(即NO的转化率)随温度的变化关系如图1所示。图中低于200℃,脱氮率随温度升高而变化不大的主要原因是___;a点(填“是”或“不是”)__对应温度下的平衡脱氮率,理由是__。
Ⅱ.向容积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)CH3OH(g)△H<0,平衡时CO的转化率随温度、压强的变化情况如图2所示。
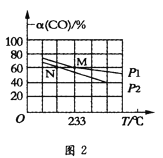
(4)反应速率:N点v正(CO)(填“大于”、“小于”或“等于”)__M点v逆(CO)。
(5)M点时,H2的转化率为__(计算结果精确到0.1%);用平衡分压代替平衡浓度计算该反应的平衡常数Kp=__(用含p1的最简表达式表达,分压=总压×物质的量分数)。
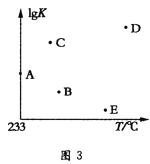
(6)不同温度下,该反应的平衡常数的对数值(lgK)如图3所示,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___(填字母符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式N2(g)+3H2(g)![]() 2NH3(g)+92kJ,下列有关图像和叙述中正确的是
2NH3(g)+92kJ,下列有关图像和叙述中正确的是
A.  B.
B. 
C. 向密闭容器中通入1mol氮气和3mol氢气发生反应放出92kJ的热量D. 形成1mol氮氮键和3mol氢氢键所放出的能量比拆开6mol氮氢键所吸收的能量多92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。
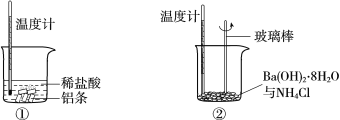
请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)①中反应的离子方程式是_________,该反应的还原剂是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铍的性质十分相似,下列关于铍的性质推断不正确的是( )
A.铍能与盐酸或氢氧化钠反应B.氢氧化铍难溶于水
C.氧化铍的化学式为![]() D.氯化铍溶液和铍酸钠溶液混合会有沉淀
D.氯化铍溶液和铍酸钠溶液混合会有沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 的分子式为C3H6O2,它与氢氧化钠溶液共热蒸馏得到含B的蒸馏产物。将B与浓硫酸混合加热,控制温度可以得到一种能使溴的四氯化碳溶液褪色,并可做果实催熟剂的气体C。B在一定温度和催化剂存在下,能被空气氧化为D,D与新制的Cu(OH)2悬浊液加热,有红色沉淀E产生。请回答下列问题:
(1)写出下列物质的结构简式:A________; B________;D__________;
(2)写出化学方程式:B→C:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属蚀刻加工过程中,常用盐酸对其表面氧化物进行清洗,会产生酸洗废水。 pH在1.5左右的某酸洗废水中含铁元素质量分数约3%,其他金属元素如铜、镍、锌、 铬浓度较低,工业上综合利用酸洗废水可制备三氯化铁。制备过程如下:
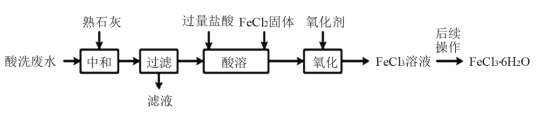
相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | Zn(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 7.1 | 5.4 | 4.3 | 7.6 |
沉淀完全的pH | 3.7 | 6.7 | 9.2 | 8.0 | 5.6 | 9.6 |
回答下列问题:
(1)“中和”时发生反应的化学方程式为__________________,调节pH至________范围,有利于后续制备得纯度较高的产品。
(2)酸溶处理中和后的滤渣,使铁元素浸出。滤渣和工业盐酸反应时,不同反应温度下 铁浸出率随时间变化如图(a)所示,可知酸溶的最佳温度为_______________。按照不同的固液比(滤渣和工业盐酸的投入体积比)进行反应时,铁浸出率随时间变化如图(b)所示,实际生产中固液比选择1.5:1的原因是___________。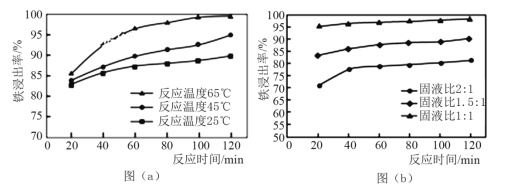
(3)氧化时,可选氯酸钠或过氧化氢为氧化剂,若100L“酸溶”所得溶液中Fe 2+含量为1.2molL1,则需投入的氧化剂过氧化氢的质量为__________。
(4)氧化时,除可外加氧化剂外,也可采用惰性电极电解的方法,此时阴极的电极反应式为__________,电解总反应的离子方程式是 __________。
(5)将得到的FeCl3溶液在HCl气氛中______、______、过滤、洗涤、干燥得FeCl36H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com