
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为_______。
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是______ (用元素符号表示)
(3)As4O6的分子结构如左下图所示,其中As原子的杂化方式为______________,1 mol As406含有σ键的物质的量为_______。


(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如右上图所示。则Y轴可表示的氢化物(RH3)性质可能是__________。
A.稳定性 B.沸点 C.R-H键能 D.分子间作用力
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是_____________________
(6)NH4+中的H—N—H的键角比 NH3中的H—N—H的键角_______(填”大”或”小”),原因是_______________________________________________
【答案】 [Ar]3d104s24p3 N>As>Ga sp3 12mol AC NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键 大 NH4+中无孤电子对,而NH3中有一对孤电子对,对成键电子对的斥力大,导致NH3中的键角小于NH4+
【解析】(1)砷是33号元素,所以基态As原子的核外电子排布式为[Ar]3d104s24p3 。
(2)同一周期元素原子序数越大,电负性越大;同一主族元素,原子序数越小,电负性越大。镓、氮、砷这3种元素中,氮和砷是第VA族元素,氮的非金属性较强,所以氮的电负性较大;砷和镓都是第4周期元素,镓是31号元素,所以的电负性由大至小的顺序是N>As>Ga
(3)看图可知,As4O6的分子中每个砷原子与邻近的3个O原子形成σ键,每个砷原子还有一个孤电子对,所以As原子的杂化方式为sp3;每 个As4O6分子中有12个σ键,所以1 mol As406含有σ键的物质的量为12mol。
(4)同一主族元素的气态氢化物,非金属性越强的越稳定,其分子内的共价键的键能越大,所以Y轴可表示的氢化物(RH3)性质可能是AC。
(5)AsH3的沸点(-62.5℃)比NH3的沸点(-33.5℃)低,原因是NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键。
(6)根据价层电子对互斥理论,孤电子对对成键电子对的斥力更大。由于NH4+中无孤电子对,而NH3中有一对孤电子对,对成键电子对的斥力大,导致NH3中的键角小于NH4+。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】【2015上海卷】实验室回收废水中苯酚的过程如右图所示。下列分析错误的是( )
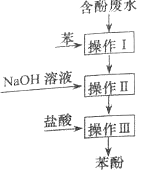
A.操作I中苯作萃取剂
B.苯酚钠在苯中的溶解度比在水中的大
C.通过操作II苯可循环使用
D.三步操作均需要分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【安徽省黄山市2017届高三第二次模拟考试理科综合】
硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O, 工艺流程如图l:
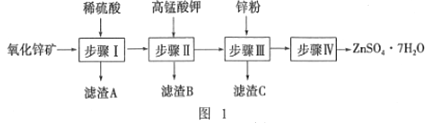
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是______。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为_____________。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______。
(6)取28.70 gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。650℃时所得固体的化学式为_______(填字母序号)。

a. ZnO b. Zn3O(SO4)2 c. ZnSO4 d. ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是 ( )
A. CS2为V形的极性分子 B. ClO3—的空间构型为平面三角形
C. SiF4和SO32—的中心原子均为sp2杂化 D. SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 分散质微粒可通过滤纸 B. 两者均能透过半透膜
C. 加入盐酸先沉淀,随后溶解 D. 两者均有丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碳酸钡可用于医疗上检查肠胃的内服剂 B. SiO2 是一种重要的半导体材料
C. 热的纯碱溶液可以去除物品表面的油污 D. MgO 可被大量用于制造火箭和飞机的部件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上曾经通过反应“3Fe+4NaOH=Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是
A. 不能用磁铁将Fe与Fe3O4分离
B. 将生成的气体在空气中冷却可获得钠
C. 该反应条件下铁的氧化性比钠强
D. 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com