
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.0g H2O与![]() 的混合物中所含质子数为NA
的混合物中所含质子数为NA
B.46g NO2 和N2O4 混合气体中含有的原子数为 3NA
C.1L 0.1 molL-1 氨水中含有 0.1NA NH3 分子
D.![]() 与
与![]() 充分反应,转移电子数为3NA
充分反应,转移电子数为3NA
【答案】B
【解析】
A.一个H2O分子中含有的中子数=8+0=8,一个D2O分子中含有中子数=8+2=10,2.0g D2O的物质的量![]() =0.1mol,含有中子数为0.1mol×10×NA=NA;2.0gH2O的物质的量为
=0.1mol,含有中子数为0.1mol×10×NA=NA;2.0gH2O的物质的量为![]() mol,含有中子数为
mol,含有中子数为![]() mol×8×NA=
mol×8×NA=![]() NA,则2.0g二者的混合物含有的中子数小于NA,故A错误;
NA,则2.0g二者的混合物含有的中子数小于NA,故A错误;
B.NO2和N2O4的最简式为NO2,46g NO2 和N2O4 混合气体最简式的物质的量为![]() =1mol,一个NO2中含有3个原子,则1mol混合气体中含有的原子数为1mol×3×NA =3NA,故B正确;
=1mol,一个NO2中含有3个原子,则1mol混合气体中含有的原子数为1mol×3×NA =3NA,故B正确;
C.1L 0.1 molL-1 氨水的物质的量为1mol,则氮元素的物质的量为0.1mol,根据氮元素守恒,氨水中氮元素以铵根离子、一水合氨分子、氨气分子形式存在,三者氮元素的总量为0.1mol,则其中含有 NH3分子的数量小于0.1NA,故C错误;
D.铁与氯气反应的方程式为2Fe+3Cl2![]() 2FeCl3,
2FeCl3,![]() 与
与![]() 充分反应,铁过量,用氯气计算,3mol氯气参与反应转移6mol电子,则1mol氯气完全反应转移2mol电子,个数为2NA,故D错误;
充分反应,铁过量,用氯气计算,3mol氯气参与反应转移6mol电子,则1mol氯气完全反应转移2mol电子,个数为2NA,故D错误;
答案选B。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组用下列装置研究原电池的原理。
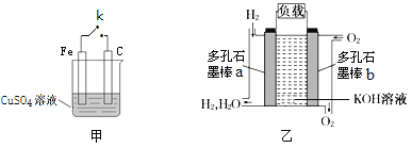
(1)装置甲电键k断开时,装置中发生反应的离子方程式为___;电键k闭合时,C棒上的现象为___,电极反应式为___。
(2)装置乙是氢氧燃料电池构造示意图,其中通入氢气的一极为电池的___极(填“正”或“负”),电极反应式为___。
(3)下列关于装置乙中原电池的总反应的说法正确的是___(填选项字母)。
A.该反应属于反应物总能量小于生成物总能量的反应
B.该反应断裂化学键吸收的总能量小于形成化学键释放的总能量
C.该反应过程中既有非极性键的断裂又有非极性键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
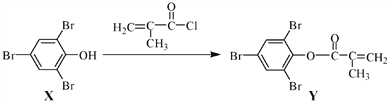
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟喹诺酮是人工合成的抗菌药,其中间体G的合成路线如下:

(1)G中的含氧官能团为_____和_____(填名称)。
(2)由C→D的反应类型是_____。
(3)化合物X(分子式为C3H7N)的结构简式为_____。
(4)B和乙醇反应的产物为H(C8H6FCl2NO2),写出满足下列条件的H的一种同分异构体的结构简式:_____。
Ⅰ.是一种α﹣氨基酸;
Ⅱ.分子中有4种不同化学环境的氢,且分子中含有一个苯环。
(5)根据已有知识并结合相关信息,写出以![]() 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备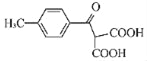 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A.苯酚与少量碳酸钠溶液的反应:![]() +CO32-→
+CO32-→![]() +HCO3-
+HCO3-
B.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH-
C.电解熔融氯化镁制镁:Mg2++2Cl-![]() Mg+Cl2↑
Mg+Cl2↑
D.铜与浓硝酸反应:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
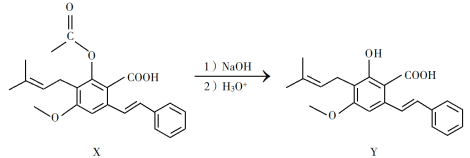
下列有关化合物X、Y的说法正确的是
A.Y与丙醇发生酯化反应可得到与X相对分子质量相同的酯
B.X、Y均能与FeCl3溶液发生显色反应
C.1 mol X与1 mol Y最多能反应的NaOH量相同
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制和治理CO2是解决温室效应及能源问题的有效途径。
已知:H2(g)和CH3OH(l)的标准燃烧热分別为△H=akJmol-1和△H=bkJmol-1
(1)研究表明,在Cu/ZnO催化剂存在下,CO2和H2 反应生成液态甲醇和液态水,该反应的热化学方程式为_________。
(2)已知:2CO2(g)+ 6H2(g)C2H4(g)+4H2O(g)△H,在两个固定容积均为1L的密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
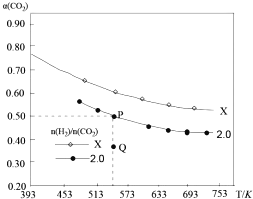
① X_______________(填“>”“<”或“=”) 2.0 ;
②若起始加入的CO2、H2的物质的量分別为1mol和2mol,计算P点时的化学平衡常数K=____________。
③比较P点和Q点的化学平衡常数:KP_________KQ(填“>”“<”或“=”),理由是__________________。
④一定温度下在体积为VL的容器中进行该反应,下列一定能说明反应达到平衡状态的是_______________(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(CO2)=v逆(C2H4)
D.容器内混合气体的密度不再变化
(3)以CH3OH作燃料,以NaOH溶液作电解质溶液形成的燃料电池,电池工作时,溶液中的阴离子向电池的哪一极定向移动(填写电极名称)________;写出负极的电极反应式_________.
(4)常温下,若在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]() ____
____![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com