
����Ŀ�����ƺ�����CO2�ǽ������ЧӦ����Դ�������Ч;����
��֪��H2��g����CH3OH��l���ı�ȼ���ȷքeΪ��H=akJmol-1�͡�H=bkJmol-1
��1���о���������Cu/ZnO���������£�CO2��H2 ��Ӧ����Һ̬�״���Һ̬ˮ���÷�Ӧ���Ȼ�ѧ����ʽΪ_________��
��2����֪��2CO2��g��+ 6H2��g��C2H4��g��+4H2O��g����H���������̶��ݻ���Ϊ1L���ܱ��������Բ�ͬ����̼��[![]() ]����H2��CO2��CO2��ƽ��ת����a��CO2�����¶ȵĹ�ϵ��ͼ��ʾ��
]����H2��CO2��CO2��ƽ��ת����a��CO2�����¶ȵĹ�ϵ��ͼ��ʾ��
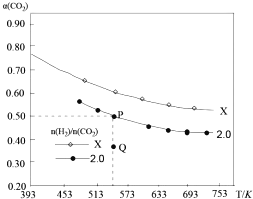
�� X_______________������>����<������=���� 2.0 ��
������ʼ�����CO2��H2�����ʵ����քeΪ1mol��2mol������P��ʱ�Ļ�ѧƽ�ⳣ��K=____________��
�۱Ƚ�P���Q��Ļ�ѧƽ�ⳣ����KP_________KQ������>����<������=������������__________________��
��һ���¶��������ΪVL�������н��и÷�Ӧ������һ����˵����Ӧ�ﵽƽ��״̬����_______________������ĸ��ţ���
A����������ƽ����Է����������ٱ仯
B��������������ѹǿ���ٱ仯
C��2v����CO2����v����C2H4��
D�������ڻ��������ܶȲ��ٱ仯
��3����CH3OH��ȼ�ϣ���NaOH��Һ���������Һ�γɵ�ȼ�ϵ�أ���ع���ʱ����Һ�е����������ص���һ�������ƶ�(��д�缫����)________��д�������ĵ缫��Ӧʽ_________��
��4�������£�����![]() ����ͭ��Һ�м�����������ϡ��Һ��ֽ��裬��dz��ɫ������ͭ�������ɣ�����Һ��
����ͭ��Һ�м�����������ϡ��Һ��ֽ��裬��dz��ɫ������ͭ�������ɣ�����Һ��![]() ʱ��
ʱ��![]() ____
____![]() ��
��
���𰸡�CO2��g��+3H2��g��CH3OH��l��+H2O��l����H= (3a-b) kJ/mol > 64L3/mol3 = �¶Ȳ��䣬K���� AB ���� ![]() 2.2��10-8
2.2��10-8
��������
��1����֪��H2(g)��CH3OH(l)�ı�ȼ���ȷքeΪakJmol-1��bkJmol-1�����H2(g)+1/2O2(g)=H2O(l) H=akJ/mol��CH3(OH)(l) +3/2O2(g)��CO2(g)+2H2O(l) H=bkJ/mol�����ݸ�˹���ɿ�֪����3���ڼ��õ�CO2��H2��Ӧ����Һ̬�״���Һ̬ˮ���Ȼ�ѧ����ʽΪ3H2(g)+CO2(g)=CH3(OH)(1)+ H2O(l) H=(3a-b)kJ/mol���ʴ�Ϊ��3H2(g)+CO2(g)=CH3(OH)(1)+ H2O(l) H=(3a-b)kJ/mol��
��2�����¶���ͬʱ��������Ũ�ȣ����CO2��ת���ʣ�����ͼ���֪X����2.0���ʴ�Ϊ������
�� 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
��ʼŨ�ȣ�mol/L��1 2 0 0
ת��Ũ�ȣ�mol/L��0.5 1.5 0.25 1
ƽ��Ũ�ȣ�mol/L��0.5 0.5 0.25 1
���P��ʱ��K=![]() =64L3/mol3���ʴ�Ϊ��64L3/mol3��
=64L3/mol3���ʴ�Ϊ��64L3/mol3��
��ƽ�ⳣ��Kֻ���¶�Ӱ�죬���¶ȱ��ֲ��䣬Kֵ���䣬P���Q����¶���ͬ����ѧƽ�ⳣ��KP����KQ���ʴ�Ϊ��=���¶Ȳ��䣬K���䡣
��A.��Ӧ����������Ϊ���壬��������ƽ����Է����������ٱ仯˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B.��Ӧǰ������������С��������������ѹǿ���ٱ仯˵����Ӧ�ﵽƽ��״̬����B��ȷ��
C.��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�v����CO2����2v����C2H4��˵���������淴Ӧ������ͬ����2v����CO2����v����C2H4������˵����Ӧ�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����C����
D.�����ڻ��������������䣬������䣬���������ڻ��������ܶ�ʼ�ձ仯�����������ڻ��������ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬����D����
�ʴ�Ϊ��AB��
��3���״�ȼ�ϼ��Ե���У�����ȼ�ϵĵ缫�Ǹ��������Լ���״��ĵ缫�Ǹ�����������ӦʽΪ��CH3OH+8OH--6e-=CO32-+6H2O����ع���ʱ����Һ�е����������صĸ��������ƶ����ʴ�Ϊ��������CH3OH+8OH--6e-=CO32-+6H2O��
��4��pH=8ʱ��c(OH-)=1��10-6mol/L������Ksp[Cu(OH)2]=c(Cu2+)��c2(OH-)=2.2��10-20����֪��c(Cu2+)=2.2��10-8mol/L���ʴ�Ϊ��2.2��10-8��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.2.0g H2O��![]() �Ļ����������������ΪNA
�Ļ����������������ΪNA
B.46g NO2 ��N2O4 ��������к��е�ԭ����Ϊ 3NA
C.1L 0.1 molL-1 ��ˮ�к��� 0.1NA NH3 ����
D.![]() ��
��![]() ��ַ�Ӧ��ת�Ƶ�����Ϊ3NA
��ַ�Ӧ��ת�Ƶ�����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����м��ܷ����ӳɷ�Ӧ��������Ӧ�����ܷ���������Ӧ���ǣ� ��
![]() ��
��![]() ��
��![]() ��
�� ![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������̬����ɵĻ���ȡ��2.24L����״���£����ȼ�գ��õ�0.16mol������̼�����3.6gҺ̬ˮ���ݴ��ж����з����в���ȷ����
A. �˻�������п��ܺ�������
B. ��������һ�����м���
C. �˻��������һ�������б���
D. ������������ϩ�����Ļ�����壬���������ϩ�������Ϊ2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ������Һ��������ȷ���ǣ� ��
A. �����µ��볣��Ϊ![]() ����HA��Һ��
����HA��Һ��![]()
B. ��0.1![]() �İ�ˮ�м�����������粒��壬����Һ��
�İ�ˮ�м�����������粒��壬����Һ��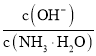 ����
����
C. ������![]() ��Һ���뵽����ʯ��ˮ�У��а�ɫ����������˵��
��Һ���뵽����ʯ��ˮ�У��а�ɫ����������˵��![]() ����
����![]()
D. 0.2![]() ��Һ��0.1
��Һ��0.1![]() ��Һ�������ϣ�2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
��Һ�������ϣ�2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ���� ( )
A. ![]() 2���һ�����B. CH3CH2CH2CH2OH 1������
2���һ�����B. CH3CH2CH2CH2OH 1������
C. ![]() �ڶ��ױ�D. CH2��C(CH3)2 2������2������
�ڶ��ױ�D. CH2��C(CH3)2 2������2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����ֵ�������й�������ȷ����(����)
A. 14 g��ϩ�ͱ�ϩ��������е���ԭ����Ϊ2NA
B. 1 mol N2��4 mol H2��Ӧ���ɵ�NH3������Ϊ2NA
C. 1 mol Fe���ڹ������ᣬ����ת����Ϊ2NA
D. ��״���£�2.24 L CCl4���еĹ��ۼ���Ϊ0.4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ�����A��B��CΪ����������Ԫ�أ�F��GΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⡣
AԪ�صĺ���������͵��Ӳ������ |
BԪ��ԭ�ӵĺ���p��������s��������1 |
Cԭ�ӵ�һ�����ĵ��������£� I1��738 kJ��mol��1��I2��1451 kJ��mol��1��I3��7733 kJ��mol��1��I4��10540 kJ��mol��1 |
F��ǰ�������е縺����С��Ԫ�� |
G�����ڱ��ĵڰ��� |
(1)��֪BA5Ϊ���ӻ����д�������ʽ��________��
(2)BԪ�ػ�̬ԭ����������ߵĵ��ӣ���������ڿռ���______������ԭ�ӹ����____�Ρ�
(3)ijͬѧ����������Ϣ���ƶ�C��̬ԭ�ӵĺ�������Ų�ͼΪ![]() ����ͬѧ�����ĵ����Ų�ͼΥ����___________________________________��
����ͬѧ�����ĵ����Ų�ͼΥ����___________________________________��
(4)Gλ�ڵ�____��____������Ԫ�صĺ�������Ų�ʽΪ_____________________���ö������Ӻ����ױ��������������ӣ���ԭ�ӹ�����۽���ԭ��________________________
(5)����FԪ�صķ�����___������ԭ�ӽṹ��֪ʶ���Ͳ����������ԭ�� ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��G�Ƕ���������Ԫ�أ�ԭ�����������������ǵIJ�����Ϣ���±���ʾ��
A | B | C | D | E | F | G | |
ԭ�Ӱ뾶/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
��Ҫ���ϼ� | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
���� | �����Ӻ������� | ���Ļ����������ڶ�ֲ����� | ��ɫ��Ӧ�ʻ�ɫ | ���ǽ������ϵ����� |
��1��F��Ԫ�����ڱ��е�λ����____________��
��2����дһ��BA4��ͬϵ��ķ���ʽ___________��
��3�����õ���ʽ��ʾDG���γɹ���____________��
��4��Ԫ��D��C��ԭ�Ӹ�����1��1�γɵĻ����������Ļ�ѧ����______���ѧ�����ͣ���
��5��D��E��ȣ������Խ�ǿ����_____����Ԫ�ط��ű�ʾ����Ԫ��D��E��۵��������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ___________
��6����ҵ��ұ������E�Ļ�ѧ����ʽΪ_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com