
【题目】下列有机物中既能发生加成反应和酯化反应,又能发生氧化反应的是( )
![]() ;
;![]() ;
;![]() ;
; ![]()
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】A
【解析】
①CH2OH(CHOH)4CHO中的醛基和羟基均能发生氧化反应,羟基能发生酯化反应,醛基可发生加成反应,故①正确;
②CH3CH2CH2OH中醇羟基能发生氧化反应、酯化反应,没有不饱和键,则不能发生加成反应,故②错误;
③CH2=CHCH2OH中的双键能够发生加成反应、氧化反应,醇羟基能发生氧化反应、酯化反应,故③正确;
④CH2=CHCOOCH3中的双键能够发生加成反应、氧化反应,但没有羟基或羧基,则不能发生酯化反应,故④错误;
⑤CH2=CHCOOH中的双键能够发生加成反应、氧化反应,羧基能够发生酯化反应,故⑤正确。
所以既能发生加成反应和酯化反应,又能发生氧化反应的是①③⑤。
故选A。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有抗菌、消炎作用,可由X制得。
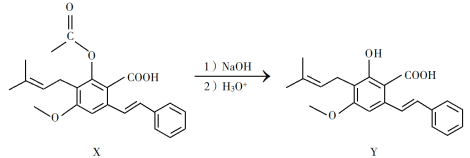
下列有关化合物X、Y的说法正确的是
A.Y与丙醇发生酯化反应可得到与X相对分子质量相同的酯
B.X、Y均能与FeCl3溶液发生显色反应
C.1 mol X与1 mol Y最多能反应的NaOH量相同
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
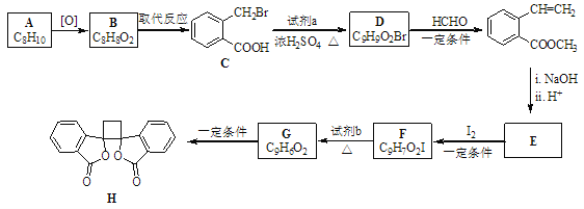
已知:
ⅰ.RCH2Br![]() R-HC=CH-R’
R-HC=CH-R’
ⅱ.R-HC=CH-R’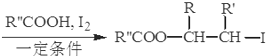
ⅲ.R-HC=CH-R’![]()
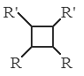
(以上R、R’、R’’代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是___。
(2)D的结构简式是___。
(3)由 F生成 G的反应类型是___。
(4)由 E与 I2在一定条件下反应生成 F的化学方程式是___。
(5)下列说法正确的是___(选填字母序号)。
A.G存在顺反异构体
B.由G生成H的反应是加成反应
C.1molG最多可以与1molH2发生加成反应
D.1 molF或1molH与足量NaOH溶液反应,均消耗2molNaOH
(6)E有多种同分异构体,请写出符合下列要求的所有同分异构体。___
①属于芳香族化合物,不考虑立体异构
②既能发生加聚反应,又能发生水解反应
③核磁共振氢谱为5组峰,且峰面积之比为1:1:2:2:2
(7)以乙烯为原料,结合题给信息设计合成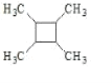 的路线。(用流程图表示,无机试剂任选)___。
的路线。(用流程图表示,无机试剂任选)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取溴的工业流程如图:

(1)步骤I中将卤水酸化,再通入Cl2,是为了防止Cl2与碱反应,写出Cl2与碱反应的离子方程式_____。
(2)步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是__________。
(3)实验室保存液溴时,通常在盛液溴的试剂瓶中加少量的水,这与液溴的_____性质有关(填写序号)。
A.氧化性 B.还原性 C.挥发性 D.密度比水大
(4)步骤II中将吹出的溴蒸汽用纯碱溶液吸收时还有CO2生成,写出吸收时发生反应的离子方程式:___。
(5)步骤II中通入热空气吹出的Br2用纯碱溶液吸收前先经过NaBr溶液,其目的是______________。
(6)步骤III中蒸馏出工业溴后残留液的主要溶质是_______________。
(7)步骤III中若使用硝酸酸化,缺点是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:

下列说法正确的是( )
A. X分子中所有原子在同一平面上
B. Y与足量H2的加成产物分子中有2个手性碳原子
C. 可用FeCl3溶液鉴别Y和Z
D. 1 mol Z最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制和治理CO2是解决温室效应及能源问题的有效途径。
已知:H2(g)和CH3OH(l)的标准燃烧热分別为△H=akJmol-1和△H=bkJmol-1
(1)研究表明,在Cu/ZnO催化剂存在下,CO2和H2 反应生成液态甲醇和液态水,该反应的热化学方程式为_________。
(2)已知:2CO2(g)+ 6H2(g)C2H4(g)+4H2O(g)△H,在两个固定容积均为1L的密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
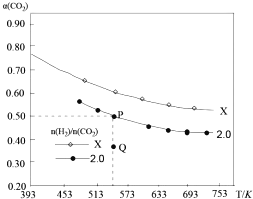
① X_______________(填“>”“<”或“=”) 2.0 ;
②若起始加入的CO2、H2的物质的量分別为1mol和2mol,计算P点时的化学平衡常数K=____________。
③比较P点和Q点的化学平衡常数:KP_________KQ(填“>”“<”或“=”),理由是__________________。
④一定温度下在体积为VL的容器中进行该反应,下列一定能说明反应达到平衡状态的是_______________(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(CO2)=v逆(C2H4)
D.容器内混合气体的密度不再变化
(3)以CH3OH作燃料,以NaOH溶液作电解质溶液形成的燃料电池,电池工作时,溶液中的阴离子向电池的哪一极定向移动(填写电极名称)________;写出负极的电极反应式_________.
(4)常温下,若在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]() ____
____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验探究元素周期律,如图所示。
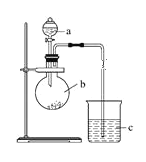
(1)仪器a的名称是____________,加入的药品为稀硝酸;仪器b的名称是____________,加入的药品为碳酸钠固体;b中反应现象为___________,验证氮的非金属性比碳的___(填“强”或“弱”)。
(2)c中装有硅酸钠溶液,c中反应现象为____,验证硅的非金属性比碳的___(填“强”或“弱”)。
(3)结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”);同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
(4)某同学考虑到稀硝酸的挥发,则应在装置b和c之间增加一个盛有_______试剂的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com