
【题目】A~G是短周期主族元素,原子序数依次增大。它们的部分信息如下表所示:
A | B | C | D | E | F | G | |
原子半径/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
主要化合价 | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
其它 | 阳离子核外无电子 | 它的化合物数量众多分布极广 | 焰色反应呈黄色 | 无机非金属材料的主角 |
(1)F在元素周期表中的位置是____________;
(2)任写一个BA4的同系物的分子式___________;
(3)请用电子式表示DG的形成过程____________;
(4)元素D与C按原子个数比1∶1形成的化合物所含的化学键有______(填化学键类型);
(5)D与E相比,金属性较强的是_____(用元素符号表示),元素D、E最高价的氧化物对应的水化物反应的离子方程式为___________
(6)工业上冶炼单质E的化学方程式为_______。
【答案】第三周期第ⅣA族 C2H6等符合CnH2n+2且n为大于或等于2的整数的分子式 ![]() 离子键、共价键或非极性键 Na Al(OH)3+OH-=AlO2-+2H2O 2Al2O3(熔融)
离子键、共价键或非极性键 Na Al(OH)3+OH-=AlO2-+2H2O 2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
【解析】
A、B、C、D、E、F、G是短周期主族元素,原子序数依次增大,A元素阳离子核外无电子,则A为H元素;B、F的化合价主要为-4,+4,则处于IVA族元素,其中B的化合物数量众多分布极广,则B是C元素,F是无机非金属材料的主角,则F为Si元素;D焰色反应呈黄色,则D为Na元素;G的主要化合价为-1,+7,原子序数最大,则G为Cl元素;E主要化合价为+3价,原子半径Na>E>Cl,则E为Al元素;C的主要化合价为-2价,为第ⅥA族元素,原子半径C<Cl,则C为O元素,由上分析可知:A为H元素,B为C元素,C为O元素,D为Na元素,E为Al元素,F为Si元素,G不Cl元素;据此解答。
(1)F为Si元素,在周期表中的位置是:第三周期第ⅣA族;答案为第三周期第ⅣA族。
(2)A为H元素,B为C元素,AB4为CH4,分子式符合CnH2n+2(n≥2)的烷烃即可,满足条件的同系物可以是C2H6;答案为C2H6。
(3)D为Na元素,G为Cl元素,形成的NaCl中Na失去一个电子,Cl得到一个电子,形成离子化合物,用电子式表示NaCl的形成过程为:![]() ;答案为
;答案为![]() 。
。
(4)D为Na元素,C为O元素,按原子个数比1:1形成的化合物为Na2O2,其电子式为![]() ,含离子键,非极性键;答案为离子键,非极性键。
,含离子键,非极性键;答案为离子键,非极性键。
(5)D为Na元素,E为Al元素,两者处于同周期,从左至右,金属性减弱,故金属性Na>Al,元素D最高价的氧化物对应的水化物为NaOH,元素E最高价的氧化物对应的水化物为Al(OH)3,两者反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;答案为Na,Al(OH)3+OH-=AlO2-+2H2O。
(6)E为Al元素,属于活泼金属,用电解法冶炼,由于熔融AlCl3不导电,因而冶炼Al是电解熔融的Al2O3,化学方程式为:2Al2O3 4Al+3O2↑;答案为2Al2O3
4Al+3O2↑;答案为2Al2O3 4Al+3O2↑。
4Al+3O2↑。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】控制和治理CO2是解决温室效应及能源问题的有效途径。
已知:H2(g)和CH3OH(l)的标准燃烧热分別为△H=akJmol-1和△H=bkJmol-1
(1)研究表明,在Cu/ZnO催化剂存在下,CO2和H2 反应生成液态甲醇和液态水,该反应的热化学方程式为_________。
(2)已知:2CO2(g)+ 6H2(g)C2H4(g)+4H2O(g)△H,在两个固定容积均为1L的密闭容器中以不同的氢碳比[![]() ]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
]充入H2和CO2,CO2的平衡转化率a(CO2)与温度的关系如图所示。
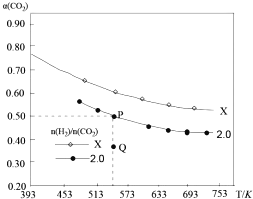
① X_______________(填“>”“<”或“=”) 2.0 ;
②若起始加入的CO2、H2的物质的量分別为1mol和2mol,计算P点时的化学平衡常数K=____________。
③比较P点和Q点的化学平衡常数:KP_________KQ(填“>”“<”或“=”),理由是__________________。
④一定温度下在体积为VL的容器中进行该反应,下列一定能说明反应达到平衡状态的是_______________(填字母序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2v正(CO2)=v逆(C2H4)
D.容器内混合气体的密度不再变化
(3)以CH3OH作燃料,以NaOH溶液作电解质溶液形成的燃料电池,电池工作时,溶液中的阴离子向电池的哪一极定向移动(填写电极名称)________;写出负极的电极反应式_________.
(4)常温下,若在![]() 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的![]() 时,
时,![]() ____
____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验探究元素周期律,如图所示。
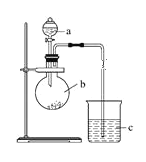
(1)仪器a的名称是____________,加入的药品为稀硝酸;仪器b的名称是____________,加入的药品为碳酸钠固体;b中反应现象为___________,验证氮的非金属性比碳的___(填“强”或“弱”)。
(2)c中装有硅酸钠溶液,c中反应现象为____,验证硅的非金属性比碳的___(填“强”或“弱”)。
(3)结论:同一周期从左到右元素非金属性逐渐____(填“增强”或“减弱”);同一主族从上到下元素非金属性逐渐_______(填“增强”或“减弱”)。
(4)某同学考虑到稀硝酸的挥发,则应在装置b和c之间增加一个盛有_______试剂的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子的轨道表示式为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能(kJ/mol) |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态Mn2+ 再失去一个电子比气态Fe2+ 再失去一个电子难,其原因是_______________________________________________________
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成Cr(CO)6 分子:价电子总数(18)= Cr的价电子数(6)+CO提供电子数(2×6).Fe原子也能与CO形成配合物,其化学式为________.
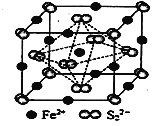
(5)FeS2晶体的晶胞如图所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程: 装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
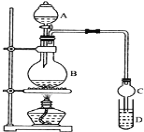
(1)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是________(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(2)球形干燥管的主要作用是_________________________。
(3)饱和Na2CO3溶液的作用是_______________________________________________________
II.提纯方法:①将D中混合液进行分离。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(4)第①步分离混合液时,选用的主要玻璃仪器的名称是_________________。
(5)第②步中用饱和食盐水洗去碳酸钠后、再用饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的__________________,______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的KW为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石膏转化为硫酸钾和CaCl2的工艺流程如图:
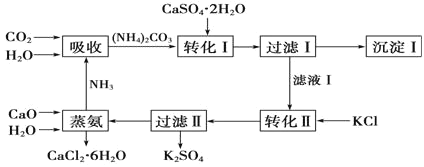
![]()
(1)CO2是一种很重要的副产品,工业上获得CO2的途径是___(用化学方程式表示)。
(2)过滤Ⅰ得到的滤液是___,检验滤液中含有CO32-的方法__。
(3)转化Ⅱ中发生反应的化学方程式为___,转化Ⅱ中可获得K2SO4的原因是__。
(4)氯化钙结晶水合物是目前常用的无机储热材料,选择的依据是___。
a.熔点较低(29℃熔化) b.能制冷
c.无毒 d.能导电
(5)废水中氨氮(主要以NH4+和NH3形式存在)的去除常见的有生物脱氮法和电解法。而电解法产生的强氧化物质HClO也可将氨氮转化为氮气而除去,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性溶液来模拟。阳极的电极反应式___,处理1mol(NH4)2SO4,需要消耗HClO物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微生物电解池(MEC)制氢工作原理如右图所示。用该电解池电解0.1mol·L-1的CH3COOH溶液,下列说法正确的是
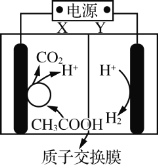
A.Y为电源的正极
B.该电解装置中,阳极的电极反应式为:CH3COOH+2H2O+8e-= 2CO2↑+8H+
C.当2mol H+通过质子交换膜时,则标准状况下产生22.4L H2
D.电解一段时间后,溶液中![]() 的值变小
的值变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com