
【题目】某课外小组设计实验室制取并提纯乙酸乙酯的方案如下:
已知:①氯化钙可与乙醇形成CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
③2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
I.制备过程: 装置如图所示,A中放有浓硫酸,B中放有9.5mL无水乙醇和6mL冰醋酸,D中放有饱和碳酸钠溶液。
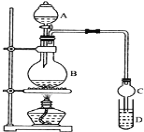
(1)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是________(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL
(2)球形干燥管的主要作用是_________________________。
(3)饱和Na2CO3溶液的作用是_______________________________________________________
II.提纯方法:①将D中混合液进行分离。
②有机层用5mL饱和食盐水洗涤,再用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。
③将粗产物蒸馏,收集77.1℃的馏分,得到纯净干燥的乙酸乙酯。
(4)第①步分离混合液时,选用的主要玻璃仪器的名称是_________________。
(5)第②步中用饱和食盐水洗去碳酸钠后、再用饱和氯化钙溶液、最后用水洗涤,分别主要洗去粗产品中的__________________,______________。
【答案】B 防倒吸 溶解挥发出的乙醇;中和挥发出的乙酸;降低乙酸乙酯的溶解度便于分层析出 分液漏斗 乙醇 氯化钙
【解析】
(1)使用烧瓶时,盛放液体的体积应在烧瓶容积的1/3~2/3之间,液体的体积为(9.5+6+3)mL=18.5mL,应使用烧瓶的容积为50mL,故B正确;
(2)反应剧烈,烧瓶中的压强迅速减小,试管中饱和碳酸钠溶液可能会被吸入发生发生装置,球形干燥管的主要作用是防止倒吸;
(3)烧瓶中挥发出的气体有乙酸乙酯、乙酸、乙醇,因此饱和碳酸钠溶液的作用是溶解挥发出的乙醇;中和挥发出的乙酸;降低乙酸乙酯的溶解度便于分层析出;
(4)D中混合液为两种互不相溶的液体,出现分层,用分液的方法进行分离,即主要仪器是分液漏斗;
(5)根据信息①氯化钙能与乙醇反应形成CaCl2·6H2O,即饱和氯化钙溶液洗去的是乙醇,水洗涤除去吸附的氯化钙。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的叙述正确的是( )
A. 常温下电离常数为![]() 的酸HA溶液中
的酸HA溶液中![]()
B. 向0.1![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中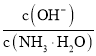 增大
增大
C. 将饱和![]() 溶液加入到饱和石灰水中,有白色沉淀产生,说明
溶液加入到饱和石灰水中,有白色沉淀产生,说明![]() 大于
大于![]()
D. 0.2![]() 溶液与0.1
溶液与0.1![]() 溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B的产量可以用来衡量一个国家的石油化工发展水平。A、B、C、D、E之间能进行如图所示的反应。
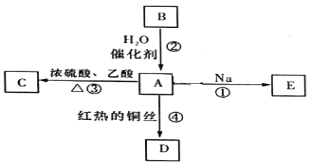
(1)A的官能团的名称________________,B的电子式为________________。
(2)写出①发生的化学反应方程式______________________。
(3)写出反应④的化学反应方程式______________________。
(4)下列关于化合物B的说法正确的是_____________(填字母)。
A.B分子中所有原子都在同一平面上
B.相同物质的量的B和甲烷完全燃烧消耗氧气的量相同
C.B可以与Cl2发生加成反应
D.B使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 酸性KI淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O
D. Na2S溶液使酚酞试液变红:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
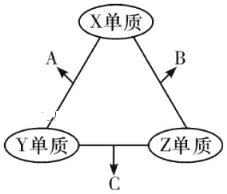
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是短周期主族元素,原子序数依次增大。它们的部分信息如下表所示:
A | B | C | D | E | F | G | |
原子半径/nm | 0.077 | 0.074 | 0.186 | 0.143 | 0.099 | ||
主要化合价 | -4,+4 | -2 | +3 | -4,+4 | -1,+7 | ||
其它 | 阳离子核外无电子 | 它的化合物数量众多分布极广 | 焰色反应呈黄色 | 无机非金属材料的主角 |
(1)F在元素周期表中的位置是____________;
(2)任写一个BA4的同系物的分子式___________;
(3)请用电子式表示DG的形成过程____________;
(4)元素D与C按原子个数比1∶1形成的化合物所含的化学键有______(填化学键类型);
(5)D与E相比,金属性较强的是_____(用元素符号表示),元素D、E最高价的氧化物对应的水化物反应的离子方程式为___________
(6)工业上冶炼单质E的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,它们之间的关系如图所示
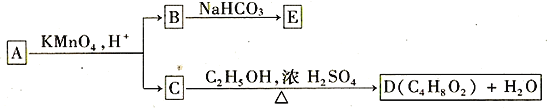
提示:①RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R'为烷基。
②RCH2OH在酸性高锰酸钾溶液中反应生成RCOOH
③酸性:RCOOH > H2CO3
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为__________________。
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1︰2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是_________________________________,反应类型为________________。
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是______________。
(4)A还能发生多种化学反应,写出A发生下列反应的化学方程式并注明反应条件:
加聚反应:_________________________________________
消去反应:________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,两个常见的固氮反应的平衡常数的对数值(lgK)与温度的关系如图所示:①N2+3H22NH3 ②N2+O22NO;根据图中的数据判断下列说法正确的是( )
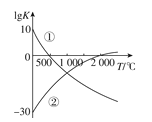
A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.在1000℃时,反应①和反应②体系中N2的浓度一定相等
D.在标准状况下,利用反应①固氮和利用反应②固氮反应程度相差很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌电池是一种极具前景的电化学储能装置。![]() 扣式可充电电池组成示意图如下。
扣式可充电电池组成示意图如下。![]() 可以在
可以在![]() 晶体中可逆地嵌入和脱除,总反应为
晶体中可逆地嵌入和脱除,总反应为![]() 。下列说法错误的是( )
。下列说法错误的是( )
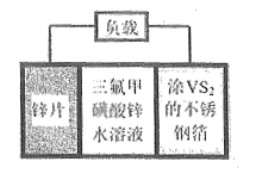
A. 放电时不锈钢箔为正极,发生还原反应
B. 放电时负极的反应为![]()
C. 充电时电池正极上的反应为:![]()
D. 充电时锌片与电源的负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com