
【题目】根据电解质在溶液中的电离情况,我们划分出了酸、碱、盐,通过学习我们知道酸和碱都有通性,而盐是没有通性的,其本质原因是( )
A.盐不能电离出阳离子
B.盐不能电离出阴离子
C.盐不能电离出H+或OH﹣
D.盐不能电离出共同的离子
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】10 mL某气态烃与50 mL氧气在密闭容器中点燃恰好完全反应,测得同条件下生成的CO220 mL、CO 20 mL、水蒸气40 mL,则该烃的分子式为
A. C2H4 B. C3H8 C. C4H8 D. C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温2 L密闭容器中通入气体X并发生反应:2X(g)![]() Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是
Y(g) ΔH<0,X的物质的量n(x)随时间t变化的曲线如图所示(图中的两曲线分别代表有无催化剂的情形),下列叙述正确的是

A.虚线表示使用催化剂的情形
B.b、c两点表明反应在相应条件下达到了最大限度
C.反应进行到a点时放出的热量大于反应进行到b点时放出的热量
D.反应从开始到a点的平均反应速率可表示为v(Y)=0.01mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产化工原料的同时会产生多右种废液,其有机废液的主要成分为苯胺、苯酚、苯甲醇(都微溶于水),其无机废液的主要污染成分为Cr2O72-,该工厂处理废液的方法如下:
I.利用物质的酸碱性,从有机废液中分离、回收有机物
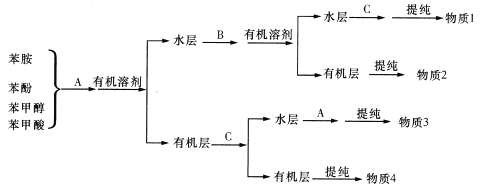
(1)物质A为______,物质B为______, 物质C为_________。(填写化学式)
(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,则应选用的试剂是______。
II.利用纳米级Cu2O处理含有Cr2O72-的酸性废水
已知:Cu2O![]() Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(4)光照时,会在形成的微电极上发生电极反应,反应原理如下图所示,

对Cu2O的作用提出两种假设:
a. Cu2O作光催化剂;
b. Cu2O与Cr2O72-发生氧化还原反应
己知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如右图所示。结合试剂用量数据和实验结果可得到的结论是假设_____成立,写出该过程的正极反应方程式:_______________。
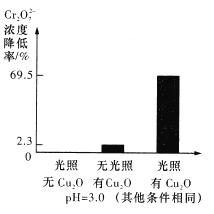
(5)溶液的pH对Cr2O72-降解率的影响如下图所示。

由上图可知,pH=3时,Cr2O72-的降解率最大;pH=2与pH=5时,Cr2O72-的降解率低的原因分别可能是___________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A、C是常见的金属单质,B是黑色有磁性的氧化物,X是黄绿色气体,Y是常见的酸,Z是常见的碱,其焰色反应显黄色。反应①需在高温下进行。

请回答下列问题:
(1) Z的电子式为________。
(2) G的化学式为________。
(3) 写出①的化学方程式:________。
(4) 写出I转化为J的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下进行反应:COCl2(g) ![]() Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法不正确的是( )
A. 使用恰当的催化剂能加快该反应速率
B. 该条件下,COCl2的最大转化率为60%
C. 6s时,反应达到最大限度即化学平衡状态
D. 生成Cl2的平均反应速率,0~2s比2~4s快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH : 6.7~7.2);第二步是把氨转化为硝酸:NH3+202![]() HNO3+H2O
HNO3+H2O
请完成下列填空:
(1)写出第一步反应的化学反应方程式_____________,第二步反应的还原产物是_____________ (填写化学式)。
(2)在KCN中,属于短周期且原子半径最大的元素是_____,氮原子最外层电子的运动状态有_______种。水的电子式是________。
(3)比较碳和氮元素非金属性强弱,化学反应方程式为_____________。
(4)室握下,0.lmol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是_____________。
(5)工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。
优点:________;缺点:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铜样品的主要成分为a CuCO3·bCu(OH)2(a、b均为最简正整数)。为测定其化学组成和Cu元素的质量分数。甲乙两个实验小组查阅资料,设计了不同的实验方案(假定杂质对实验无干扰)。
Ⅰ.甲组同学利用一下方法测定:
①在一定质量的样品中加入过量的稀硫酸,过滤,测量产生气体的体积
②在滤液中加过量的NaOH稀溶液,过滤
③灼烧②中所得滤渣、直至残留固体恒重
(1)为了除去滤渣中的可溶性杂质,需要对滤渣进行的操作是_____,滤渣应在_____(填仪器名称)中进行灼烧。
(2)利用右图装置测量气体体积,读数时应注意:
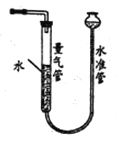
①恢复至室温;②__________;③平视且视线与凹液面最低点相切。
若操作无误,但气体体积测量结果仍然明显偏低,合理的改进措施是____________。
(3)甲组同学在处理实验数据时,将常温常压下测得的气体体积VL换算成V/22.4mol进行计算,则计算所得a值将_______(填“偏大”、“偏小”或“无影响”)。
Ⅱ.乙组同学利用下图装置进行测量(夹持及加热装置略去):
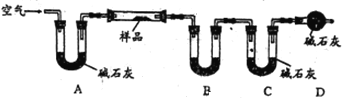
(4)U型管B中的药品是_________,D的作用是_________。
(5)若样品的质量为20g,充分反应后测得B中固体质量增加了0.9g,C中固体质量增加了4.4g,则样品中主要成分的化学式为___________,样品中铜元素的质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com