
����Ŀ����ҵ�Ͽ������ﴦ����KCN�ķ�ˮ����һ������������������������£���KCNת����KHCO3��NH3�����pH : 6.7��7.2)���ڶ����ǰѰ�ת��Ϊ���NH3+202![]() HNO3+H2O
HNO3+H2O
�����������գ�
��1��д����һ����Ӧ�Ļ�ѧ��Ӧ����ʽ_____________���ڶ�����Ӧ�Ļ�ԭ������_____________ ����д��ѧʽ����
��2����KCN�У����ڶ�������ԭ�Ӱ뾶����Ԫ����_____����ԭ���������ӵ��˶�״̬��_______�֡�ˮ�ĵ���ʽ��________��
��3���Ƚ�̼�͵�Ԫ�طǽ�����ǿ������ѧ��Ӧ����ʽΪ_____________��
��4�������£�0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С���ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����_____________��
��5����ҵ�ϻ�������������������KCN�ķ�ˮ��KCN+2KOH+Cl2=KOCN+2KCl+H2O��2KOCN+4KOH+3Cl2��N2+6KCl+2CO2+2H2O��������ȣ����ﴦ�������ŵ���ȱ���ǣ���дһ������
�ŵ㣺________��ȱ�㣺__________________��
���𰸡� 2KCN+O2+4H2O![]() 2KHCO3+2NH3 (2�֣�HNO3 H2O ̼(C) 5
2KHCO3+2NH3 (2�֣�HNO3 H2O ̼(C) 5 ![]() NaHCO3+HNO3=NaNO3+CO2��+H2O c(HCO3-)>c(CN-)>c(CO32-) ������Һ��й©�� ������Ӧ�Բ�ȡ�
NaHCO3+HNO3=NaNO3+CO2��+H2O c(HCO3-)>c(CN-)>c(CO32-) ������Һ��й©�� ������Ӧ�Բ�ȡ�
����������1�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��Ӧ�ﻹ��ˮ�����ε�һ����Ӧ�Ļ�ѧ��Ӧ����ʽΪ2KCN+O2+4H2O![]() 2KHCO3+2NH3���ڶ�����Ӧ������������������ԭ������HNO3��H2O����2����KCN�У����ڶ����ڵ���C��N��ͬ������������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶����Ԫ����C����ԭ���������5�����ӣ����ε��ӵ��˶�״̬��5�֡�ˮ�ǹ��ۻ��������ʽ��
2KHCO3+2NH3���ڶ�����Ӧ������������������ԭ������HNO3��H2O����2����KCN�У����ڶ����ڵ���C��N��ͬ������������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶����Ԫ����C����ԭ���������5�����ӣ����ε��ӵ��˶�״̬��5�֡�ˮ�ǹ��ۻ��������ʽ��![]() ����3����������̼�����Ʒ�Ӧ����̼�ᣬ˵����Ԫ�صķǽ�����ǿ��̼Ԫ�أ���ѧ��Ӧ����ʽΪNaHCO3+HNO3=NaNO3+CO2��+H2O����4��������0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С��˵��������ӵ�ˮ��̶����μ�С�������ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����c(HCO3-)>c(CN-)>c(CO32-)����5�����ݷ�Ӧ�ķ���ʽ���ж����ﴦ�������ŵ��ǣ���ȱ����������Ӧ�Բ�ȡ�
����3����������̼�����Ʒ�Ӧ����̼�ᣬ˵����Ԫ�صķǽ�����ǿ��̼Ԫ�أ���ѧ��Ӧ����ʽΪNaHCO3+HNO3=NaNO3+CO2��+H2O����4��������0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С��˵��������ӵ�ˮ��̶����μ�С�������ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����c(HCO3-)>c(CN-)>c(CO32-)����5�����ݷ�Ӧ�ķ���ʽ���ж����ﴦ�������ŵ��ǣ���ȱ����������Ӧ�Բ�ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������л������㣺
��1��9.2g����������NOx�е�ԭ�ӵ����ʵ���Ϊ0.2mol����NOx��Ħ������Ϊ________����������NOx�ڱ�״���µ����ԼΪ________��
��2��19.2g Cu������ϡ���ᷴӦʱ��ת�Ƶ���������_____NA��NA��ʾ����ӵ���������
��3��Ԫ��M��ij��ԭ�ӣ����Ȼ��MCl2��11.1g�����Һ������1mol/L��AgNO3��Һ200mL���ܰ���������ȫ������������֪��ԭ���У�������=��������
�� ��ԭ��M��������AΪ_____________��
�� д����ԭ�ӣ����أ�����___________��
�� MԪ�������ڱ��е�λ����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ˮʱ���ƻ�ˮ�ĵ���ƽ�⣬�����ڵ���ʵ��ǣ� ��
A. ����
B. ��ˮ
C. �Ȼ���
D. �Ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ��������Һ�еĵ�����������ǻ��ֳ����ᡢ��Σ�ͨ��ѧϰ����֪����ͼ��ͨ�ԣ�������û��ͨ�Եģ��䱾��ԭ���ǣ� ��
A.�β��ܵ����������
B.�β��ܵ����������
C.�β��ܵ����H+��OH��
D.�β��ܵ������ͬ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ��ٴӵ�����Ȼ�̼��Һ�з�����⣻�ڴ��Ȼ��ƺ͵������ˮ��Һ�з�����壻�ۺ���ˮ�ݵ�ֲ�����г�ȥˮ�ݣ��ܷ��붹���Ͷ������������ϻ�������ȷ���������ǣ�������
A.������ȡ����Һ������
B.��ȡ������Һ������
C.��ȡ������Һ������
D.������ȡ����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����������������ı�����Һ�н�������Ũ�ȵĸ���������Һ��pH��ϵ����ͼ��ʾ������˵����ȷ����
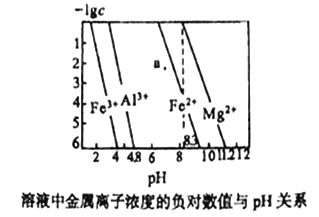
A. a�����Fe(OH)2������Һ
B. Ksp[Fe(OH)3]< Ksp[Al(OH)3]< Ksp[Fe(OH)2]< Ksp[Mg(OH)2]
C. ��0.1mol/L Al3+��Mg2+��Fe2+�����Һ�У���εμ�ϡNaOH��Һ��Mg2+���ȳ���
D. ��pH=7����Һ�У�Fe3+��Al3+��Fe2+�ܴ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ�У�������ǣ� ��
A.H2CO3H++HCO3���� HCO3��H++CO32��
B.H2SO4�T2H++SO42��
C.NaHS�TNa++H++S2��
D.CH3COOHH++CH3COO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 mol��L-1NaOH��Һ�ֱ�ζ�20.00 mLŨ�Ⱦ�Ϊ 0.10mol L-1��CH3COOH(Ka=1.75��10-5)��Һ��HCN (Ka=4.9��10-10)��Һ���õζ�������ͼ������˵����ȷ����

A. ����I�����ߢ�ֱ��������CH3COOH��HCN
B. ��ۺ͵����ʾ��Һ�У�c(CN-)=c(CH3COO-)
C. ��ٺ͵����ʾ��Һ�У�c��CH3COO-��-c��CN-��=c��HCN��-c��CH3COOH��
D. �ڵ�ں͢�֮�䣨�������˵������ڹ�ϵ�� c(Na+)>c(A-)>c(H+)>c(OH-) (A-������Һ�е�������ӣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2015�㽭�����ڹ�̬��������������У����¹����H2O��CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
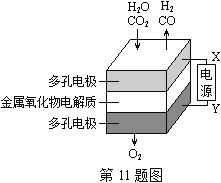
A��X�ǵ�Դ�ĸ���
B�������ķ�Ӧʽ�ǣ�H2O��2e����H2��O2�� CO2��2e����CO��O2��
C���ܷ�Ӧ�ɱ�ʾΪ��H2O��CO2H2��CO��O2
D���������������ɵ���������ʵ���֮����1�U1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com