
【题目】常温,向20 ml0.1mol/L的CH3COOH溶液中滴加等浓度的NaOH溶液,已知由水电离出的氢氧根离子浓度c水(OH-)随滴入的NaOH溶液的体积变化如图所示,下列说法错误的是( )
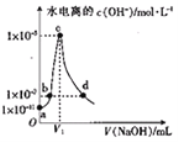
A. 常温下,醋酸的电离常数约为1×10-5
B. b、d两点溶液中均存在c(Na+)=c(CH3COO-)
C. V1=20
D. c点溶液存在:c(OH-)=c(CH3COOH)+c(H+)
科目:高中化学 来源: 题型:
【题目】(1)只用一种试剂或操作,除去下列物质中的杂质(括号内为杂质),先写出除杂时所选试剂或者操作,再写出发生的有关化学方程式。
①Fe2O3(Al2O3):___ ___
②FeCl2溶液(FeCl3):___ ___
③Na2CO3(NaHCO3):___ ___
(2)写出以下反应的化学方程式或离子方程式。
呼吸面具中CO2与过氧化钠反应化学方程式:___;
烧碱溶液与铝片的反应离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
I.氯系消毒剂在生活中有广泛应用。
(1)NaClO2是饮用水的消毒剂,常用FeSO47H2O清除残留的亚氯酸钠。
①Fe2+的电子排布式为[Ar]________________________________。
②与SO42-互为等电子体的分子有____________________(写一种)。
③ClO2-中氯原子的孤电子对数为___________。
④常用K3[Fe(CN)6]检验水中的F2+。K3[Fe(CN)6]的配体是________________。
(2)ClO2是新一代饮用水消毒剂。沸点:ClO2________________(填“>”“<”或“=”)Cl2O,理由是________________________________________________。
Ⅱ.Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。
(2)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:![]()
①有同学书写基态碳原子的核外电子排布图为![]() ,这样的书写不正确,违背了________。
,这样的书写不正确,违背了________。
②乙醛和乙醇的相对分子质量相差2,但是乙醇的沸点远高于乙醛,其主要原因是_______。
(2)Fe、Fe2+都能被硝酸氧化。HNO3中氮原子轨道的杂化类型为_______________________。
(3)NO能被FeSO4溶液吸收生成配合物![]() ,该配合物中心离子的配位数为__________________________。
,该配合物中心离子的配位数为__________________________。
(4)研究发现,阳离子的颜色与未成对电子数有关。例如,Cu2+、Fe2+、Fe3+等。Cu+呈无色,其原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体在标况下的密度为__________g/L。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于0.1L水中(水的密度:1g·mL-1,且不考虑反应),其溶液中溶质的质量分数为_____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:

采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
(1)加试剂前要进行的操作是_______________。
(2)浓硫酸_______ (填“能”或“不能”)用稀硫酸代替,原因是______________。
(3)从装置Ⅱ中分离出产品可采取的分离方法是_____。
(4)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为___________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2) Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为________(各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
(5)化合物甲由X、Z、M、W和Fe五种元素组成,甲的摩尔质量为392g·mol-1, 1 mol甲中含有6 mol结晶水。对化合物甲进行如下实验:
a.取甲的水溶液少许,加入过量的浓NaOH溶液,加热,产生白色絮状沉淀和无色、有刺激性气味的气体;白色絮状沉淀迅速变成灰绿色,最后变成红褐色。
b.另取甲的水溶液少许,加入过量的BaCl2溶液,产生白色沉淀;再加盐酸,白色沉淀不溶解。
① 甲的化学式为________。
② 已知100 mL 1 mol·L-1的甲溶液能与20 mL 1 mol·L-1的酸性KMnO4溶液恰好反应,写出反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-二氧六环的一种合成方法如下,下列说法正确的是
CH2=CH2![]()
![]()
![]()
A.反应①、②的原子利用率均为100%
B.反应②的反应类型是加成聚合反应
C.环氧乙烷分子中的所有原子处于同一平面
D.与1,4-二氧六环互为同分异构体的酯类只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式__________,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为_______。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2![]() 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si![]() Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
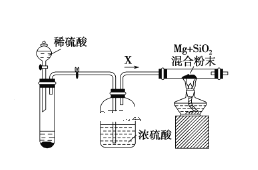
(2)由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.Na2SO3 b.锌粒 c.纯碱
(3)实验开始时,必须先通入X气体,再加热反应物,其理由是________,当反应开始后,移走酒精灯反应能继续进行,其原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com