
(12分)碱式硫酸铁[Fe(OH) SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
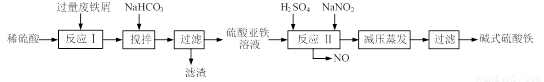
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(1)Al3+ 加快反应速率
(2)氧化剂 2mol
(3)2Fe(OH)2++2H2O Fe2(OH)42++2H+
Fe2(OH)42++2H+
(4)D
【解析】
试题分析:(1)废铁中有氧化铝杂质,所以加入碳酸氢钠来调节PH值到弱碱性,来沉淀铝离子。搅拌的作用是使固体物质充分与液体物质接触,加快反应速率。(2)氧气而亚硝酸钠都作氧化剂,把二价铁氧化成三价铁。反应的氧气为11.2L,则为0.5mol,得电子2mol,要得到等物质的量的电子,则需要亚硝酸钠为2mol(3)水解反应的反应物为Fe(OH)2+和水,产物是Fe2(OH)42+和氢离子。(4)用酸性高锰酸钾溶液检验,现象褪色,比较明显。
考点:化学实验,铁及铁的化合物性质。
点评:本题以化工生产为背景,综合性较强,整体难度不大。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解

| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量 0.5mol.L-1BaCl2 0.5mol.L-1BaCl2 . |
产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) . |
若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2, 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
硫酸亚铁是比较重要的亚铁盐,在农业上用作农药,主治小麦黑穗病,在工业上用于染色、制造蓝黑墨水和木材防腐、除草剂等.
(1)实验室条件下用铁粉和稀硫酸制取少量硫酸亚铁溶液,为防止其变质,应在该溶液中应加入适量______.
(2)新制的绿矾晶体(FeSO4?7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______.
(3)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8°C,沸点是44.8°C.
①装置II的试管中不装任何试剂,其作用是______,试管浸泡在50℃的热水浴中,目的是______.
②装置III和装置IV的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol.L-1.H2S04、6mol.L-1 NaOH、0.5mol.L -1 BaCl2、O.5mol.L-1Ba(NO3)2、0.01mol.L-1 酸性 KMnO4 溶液、0.0l mol.L-1 溴水.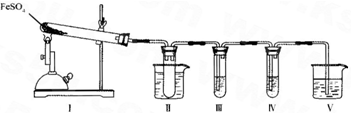
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
③装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是______.
④如何检验装置Ⅰ中固体完全分解后生成固体产物有无FeO?写出步骤、现象及结论:______.
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
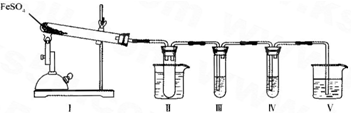
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
查看答案和解析>>
科目:高中化学 来源:2011年福建省泉州五中高考化学模拟试卷(解析版) 题型:解答题
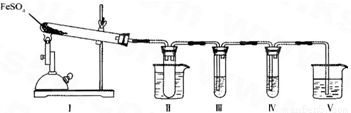
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入足量______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置IV的试管中加入足量______. | ______ ______. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com