
【题目】(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是__,烧杯的实际质量为__(最小砝码为5g)。

(2)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常稀释100倍(体积之比)后使用。请回答下列问题:
有效成分 | NaClO |
规格 | 1000mL |
质量分数 | 25% |
密度 | 1.19g·cm-1 |
①该“84”消毒液物质的量浓度约____ mol·L-1(保留一位小数)。
②某同学取20mL该“84”消毒液,稀释后用于消毒,稀释后的溶液中c(Na+)=__mol·L-1。
③“84”消毒液与稀硫酸混合使用可增强消毒能力,某消毒小组人员用浓硫酸配制稀硫酸用于增强“84”消毒液的消毒能力,下列操作使所配制的硫酸溶液浓度偏低的是__。
a.量取浓硫酸时,俯视量筒刻度线 b.未经冷却就将溶液转移至容量瓶
c.溶液定容摇匀后,有少量流出 d.没有洗涤量取浓硫酸的量筒
e.定容时仰视容量瓶刻度线 f.容量瓶内残留一定量蒸馏水
【答案】砝码与烧杯放反了位置 27.4 4.0 0.04 ae
【解析】
(1)天平称量物体时遵循左物右码的原则,在该实验图中可以看出,该同学在操作时的一个错误是砝码与烧杯放反了位置,根据天平平衡原理:左盘物体质量=右盘砝码质量+游码质量,若果放反了,则左盘砝码质量=右盘物体质量+游码质量,所以右盘物体质量=左盘砝码质量-游码质量=30g-2.6g=27.4g;
(2)①c(NaClO)![]()
![]()
②稀释后c(NaClO)=![]() ×4.0mol·L1=0.04mol·L1,则c(Na+)=0.04mol·L1;
×4.0mol·L1=0.04mol·L1,则c(Na+)=0.04mol·L1;
③a.量取浓硫酸时,俯视量筒刻度线,导致量取的浓硫酸体积减小,溶质的物质的量偏小,则溶液的浓度偏低,故a符合题意;
b.未经冷却就将溶液转移至容量瓶,待溶液冷却至室温,溶液体积减小,则溶液的浓度偏高,故b不符合题意;
c.溶液定容摇匀后,有少量流出,溶液已经配制完成,流出少量不影响溶液浓度,即溶液的浓度不变,故c不符合题意;
d.量取浓硫酸的量筒不需要洗涤,未洗涤量筒,不影响浓度,即溶液的浓度不变,故d不符合题意
e.定容时仰视容量瓶刻度线,导致溶液总体积偏大,溶液的浓度偏低,故e符合题意;
f.容量瓶内残留一定量蒸馏水,不影响溶液配制,溶液的浓度不变,故f不符合题意;
答案选a e。


科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。试完成以下问题:

(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是____________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式) 。
(5)装置丁的现象是________,说明________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学教师为“氯气与金属钠反应”设计了如图装置的实验。实验操作:先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述中错误的是
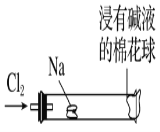
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气
C.钠着火产生黄色火焰,自然界中存在游离态钠
D.若在棉花球外沿滴一滴石蕊溶液,据其颜色变化判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)CH3OH(g);△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H2
①上述反应中原子利用率百分之百的是______(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1______0,T℃时,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,此时T为______。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是
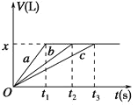
A. x=2.24
B. 三种金属的物质的量均为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照要求计算:
①19.6克硫酸含有_____mol氧原子,将这些硫酸溶于水配成500mL溶液,从其中取出100mL可以消耗1mol/L的NaOH溶液______mL。
②__gH2O2所含原子数与0.2molH3PO4所含原子数相等,该H2O2中所含质子数为__,假设一个铁原子的质量为a克,那么其相对原子质量可表示为__(阿伏加德罗常数为NA)。
③在标准状况下,密度为0.75g/L的氨气和甲烷的混合气体中,氨气的体积分数为_____,该混合气体对氢气的相对密度为______。
④已知agA和bgB恰好完全反应生成0.2molC和dgD,则C的摩尔质量为__。
⑤将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,取出50mL溶液正好与0.02moL的AgNO3溶液完全作用,4.06g的MgCl2·xH2O物质的量为__,式中x的数值____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是

A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.10s后,该反应停止进行
C.反应开始到10s,用Z表示的反应速率为0.158mol·L-1·s-1
D.0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验方法和结论正确的是 ( )
A. 加入硝酸银溶液有白色沉淀生成,证明原溶液中一定有Cl-
B. 在加入稀硝酸后的溶液中,再滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定有SO![]()
C. 加入盐酸后加热,放出能使澄清石灰水变浑浊的无色无味气体,证明原溶液中一定含有CO![]()
D. 加入紫色石蕊试液,溶液显红色,证明溶液一定呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com