
 (3)
(3)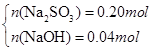
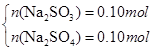
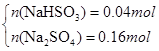
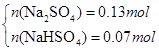
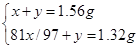

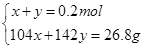
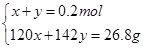


科目:高中化学 来源:不详 题型:单选题
| A.1 mol甲醇中含有C—H键的数目为4NA |
| B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C.标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
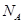 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是A.2.4g镁与足量的盐酸反应,电子转移数目为0.1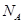 |
B.0.5mol/L的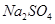 的溶液中含 的溶液中含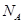 个 个 |
C.1mol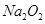 固体中含2 固体中含2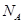 个阴离子 个阴离子 |
D.1mol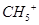 离子所含电子数为10 离子所含电子数为10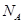 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,2.24 L SO3所含分子数目为0.1NA |
| B.6.0gSiO2中含氧分子的数目为0.1NA |
| C.78g Na2O2固体中含Na+离子的数目为NA |
| D.2.3gNa完全燃烧后失去电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al | B.Mg | C.Na | D.三者产生的氢气一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.密封保存的46 g NO2气体含有的分子数为NA |
| B.0.1 mol/L 碳酸钠溶液中阴离子总数大于0.1 NA |
| C.标准状况下,22.4 L HF中含有的氟原子数目为NA |
| D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com