
科目:高中化学 来源: 题型:
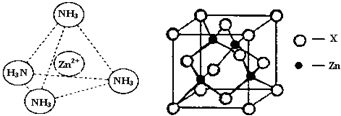
查看答案和解析>>
科目:高中化学 来源: 题型:022
碳元素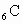 与某非金属元素R形成化合物
与某非金属元素R形成化合物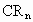 ,已知
,已知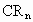 分子中各原子核最外层电子数之和为32,核外电子总数为42,则R为________,n等于_________,化合物
分子中各原子核最外层电子数之和为32,核外电子总数为42,则R为________,n等于_________,化合物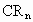 的化学式为______________.
的化学式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:038
碳元素与某非金属元素R形成化合物CRx,已知CRx分子中各原子最外层电子数之和是32,核外电子数之和为74,则R是什么元素,x等于多少?并写出R元素最高价氧化物及对应水化物的化学式。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
碳元素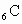 与某非金属元素R形成化合物
与某非金属元素R形成化合物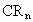 ,已知
,已知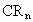 分子中各原子核最外层电子数之和为32,核外电子总数为42,则R为________,n等于_________,化合物
分子中各原子核最外层电子数之和为32,核外电子总数为42,则R为________,n等于_________,化合物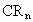 的化学式为______________.
的化学式为______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com