
(15分)已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3  Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
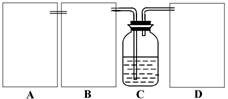
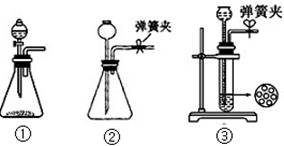
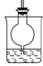
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下 装置(填序号)。简述该装置能随关随停的理由 。
(2)为使实验能够进行,在B、D方框内补上所需装置: (将装置图画在答题卡上),并指明所用试剂: 。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是 。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为 。
(15分)(1)③(1分), 关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应 (2分)
(2)试剂:饱和碳酸氢钠溶液 试剂:稀硫酸或水(画图2分,试剂1分,共6分)
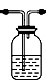
(3)将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中)(3分)
(4)65%(3分)
【解析】(1)要满足使反应随开随用,随关随停,则必需选择③。因为关闭弹簧夹后反应生成的气体使上部压强增大,到达一定程度后可把反应液压回漏斗,使固液分离从而停止反应,而装置①②达不到该要求。
(2)进入装置C的CO2应该是纯净的,但反应中生成的CO2中含有氯化氢气体,所以必需通过饱和碳酸氢钠溶液除去CO2中的氯化氢气体。由于C中反应是放热反应,从而导致氨气的挥发逸出。由于氨气是极易溶于水的,所以在吸收多余氨气时,应该防止液体倒流,装置图见答案。
(3)由于反应是放热反应,而碳酸氢钠的溶解度随温度的升高而增大,所以要析出大量晶体,可以将C装置浸泡在一个盛有冰水混合物的水槽里(或大烧杯中)。
(4)5.85g氯化钠是0.1mol,生成碳酸氢钠也是0.1mol,质量是8.4g,所以Na2CO3的产率为5.46÷8.4×100%=65%。


科目:高中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3 Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下 装置(填序号)。简述该装置能随关随停的理由 。
(2)为使实验能够进行,在B、D方框内补上所需装置: (将装置图画在答题卡上),并指明所用试剂: 。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是 。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高一第三次月考化学试卷(解析版) 题型:实验题
(11分)已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3 Na2CO3 +CO2↑+H2O
Na2CO3 +CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。
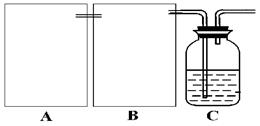
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下 装置(填序号)。简述该装置能随关随停的理由 。
(2)为使实验能够进行,在B方框内内应选用上图中的 装置(填写序号),该装置内应装入的试剂是 。
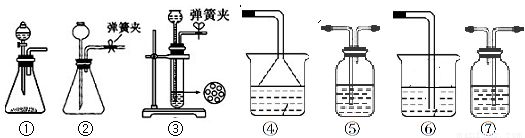
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是 。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为 (产率为实际产量占理论产量的百分比)。
查看答案和解析>>
科目:高中化学 来源:2014届山东省济宁市高一上学期期末模拟化学试卷 题型:实验题
(15分)已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
① NaCl (饱和) + NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
② 2NaHCO3  Na2CO3
+CO2↑+H2O
Na2CO3
+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。

(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下 装置(填序号)。简述该装置能随关随停的理由 。

(2)为使实验能够进行,在B、D方框内补上所需装置: (将装置图画在答题卡上),并指明所用试剂: 。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是 。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com