
下列与含氯化合物有关的说法正确的是
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3 mol·L-1H2SO4溶液,在60 ℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有_______________________________
(填仪器编号);
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是________________________________
________________________________________________________________________。
(3)在步骤3中,“一系列操作”依次为____________________、________________和过滤。
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是____________,可以观察到的现象是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
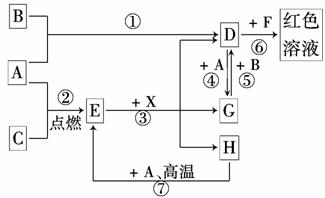
(1)写出化学式:A________、D________、E__________、X__________。
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应 ⑥的离子方程式为:______________________________________________。
⑥的离子方程式为:______________________________________________。
(4)反应⑦的化学方程式为_______________________________________________;
该反应中每消耗0.3 mol的A,可转移电子________ mol。
 (5)写出D的溶液与小苏打溶液反应的离子方程式:__________________________
(5)写出D的溶液与小苏打溶液反应的离子方程式:__________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应(1)2P+5Br2+8H2O=2H3PO4+10HBr
(2)Cl2+2HBr=2HCl+Br2
(3)2KMn04+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
推断氧化性(氧化剂)由强到弱的顺序是 。
还原性(还原剂)由强到弱的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重 要的应用。
要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) △H1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) △H2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) △H3
则△H3= kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是 。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。
①为获得尽可能纯的NaH2PO4,pH应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 。
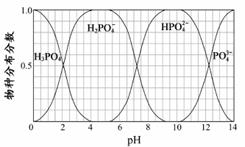
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是
(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(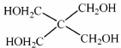 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X 的核磁共振氢谱如下图所示。
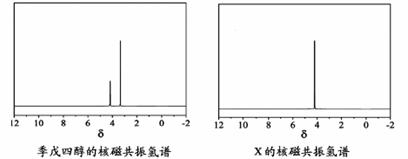
①酸性气体是 (填化学式)。
②X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
己知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
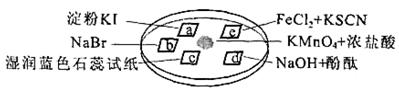
对实验现象的“解释或结论”正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+ > Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是一种化工原料,可以制备一系列物质(见图4)。下列说法正确的是
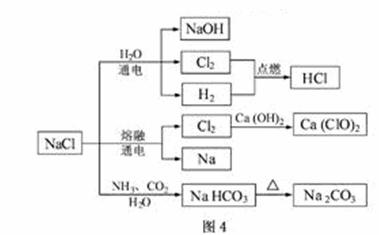
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图4所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质①乙烷 ②乙炔
③甲苯 ④苯 ⑤聚乙烯 ⑥对苯二酚 ⑦溴乙烷 ⑧葡萄糖,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )
A.②③④⑤⑧ B.②③④⑥⑦⑧
C.②⑥⑧ D.②⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com