
合金是建造航空母舰的主体材料。
(1)航母升降机可由铝合金制造。
①铝元素在周期表中的位置为________。工业炼铝的原料由铝土矿提取而得,提取过程中通入的气体为________。
②Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为____________________________________。
焊接过程中使用的保护气为________(填化学式)。
(2)航母舰体材料为合金钢。
①舰体在海水中发生的电化学腐蚀主要为________。
②航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为________。
(3)航母螺旋桨主要用铜合金制造。
①80.0 g Cu-Al合金用酸完全溶解后,加入过量氨水,过滤得白色沉淀39.0 g,则合金中Cu的质量分数为________。
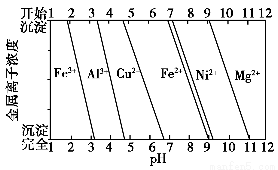
②为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀,结合题图信息推断该合金中除铜外一定含有________。
(1)①第三周期第ⅢA族 CO2 ②Al2O3+2NaOH=2NaAlO2+H2O Ar(其他合理答案均可得分)
(2)①吸氧腐蚀 ②CaCO3或CaO (3)①83.1% ②Al、Ni
【解析】本题围绕金属材料命题,要根据题目设问的角度,联系相关知识解答。(1)①Al元素在周期表中的第三周期第ⅢA族;提纯铝土矿通入CO2发生的反应为2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32—。②Al2O3与NaOH溶液发生的反应为Al2O3+2NaOH=2NaAlO2+H2O;保护气应不能与金属反应,一般用稀有气体。(2)金属在海水中主要发生吸氧腐蚀;炼钢过程中为降低Si的含量,常加入CaCO3或CaO将SiO2转化为CaSiO3而除去。(3)①因加入过量的氨水会发生反应Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,故得到的白色沉淀为Al(OH)3,物质的量为0.5 mol,据Al元素守恒可知Al的质量为13.5 g,则Cu的质量为66.5 g,Cu的质量分数约为83.1%。②由图像可知,Fe3+在pH≈1.9时开始沉淀,在pH≈3.2时沉淀完全,依次类推。pH=3.4时才开始出现沉淀,说明溶液中没有Fe3+,则一般也无Fe2+,因为Fe2+在空气中会被氧化成Fe3+,此时的沉淀为Al(OH)3;pH=7.0时过滤出的沉淀为Al(OH)3和Cu(OH)2;pH=8.0时过滤出的沉淀为Ni(OH)2。
点拨:知识:金属材料、元素在周期表中的位置、铝的化合物的性质;金属的冶炼与腐蚀;混合物的计算及金属离子沉淀的pH。能力:运用所学相关知识分析问题生解决问题的能力。试题难度:中等。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本理论练习卷(解析版) 题型:填空题
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72—转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格)。

测得实验①和②溶液中的Cr2O72—浓度随时间变化关系如图所示。

(2)上述反应后草酸被氧化为______________(填化学式)。
(3)实验①和②的结果表明________;实验①中0~t1时间段反应速率v(Cr3+)=________mol·L-1·min-1(用代数式表示)。
(4)该课题组对铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:________;
假设三: ________;
……
(5)请你设计实验验证上述假设一,完成下表中内容。[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。溶液中Cr2O72—的浓度可用仪器测定]
实验方案 (不要求写具体操作过程) | 预期实验结果和结论 |
|
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液:K+、Na+、Cu2+、SO42—
B.c(OH-)=10-13mol· L-1的溶液:Al3+、NO3—、I-、Cl-
C.水电离产生的c(H+)=10-13mol·L-1的溶液:Na+、Cl-、NO3—、SO42—
D.0.1 mol·L-1 FeSO4溶液:K+、NH4+、MnO4—、ClO-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:

(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。

(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:选择题
工业上利用H2在Cl2中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
A.两极材料都是石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通入氯气的电极移动
D.通氯气的电极反应为Cl2+2e-=2Cl-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 元素及其化合物练习卷(解析版) 题型:选择题
相对分子质量为100的烃,且含有4个甲基的同分异构体共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 元素及其化合物练习卷(解析版) 题型:选择题
新课程倡导合作学习和探究学习。科学的假设与猜想是科学探究的前提,在下列假设(猜想)引导下的探究肯定没有意义的选项是( )
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应生成的气体可能是O2
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuO
D.探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第9讲非金属元素化合物练习卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:  丙。下列有关物质的推断不正确的是( )。
丙。下列有关物质的推断不正确的是( )。
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第5讲化学反应与能量练习卷(解析版) 题型:选择题
为保护环境并缓解能源危机,专家提出利用太阳能促使燃烧循环使用的构想,转化关系如图所示。
已知:

(1)过程Ⅰ可用如下反应表示:①2CO2 2CO+O2
2CO+O2
②2H2O(g)  2H2+O2
2H2+O2
③2N2+6H2O 4NH3+3O2
4NH3+3O2
④2CO2+4H2O 2CH3OH+3O2
2CH3OH+3O2
⑤2CO+4H2O ________+3O2。
________+3O2。
(2)25 ℃时,a g CH4完全燃烧释放出b kJ热量。下列说法不正确的是( )。
A.过程Ⅰ是将太阳能转化成化学能
B.反应⑤的另一种产物为CH4
C.ΔH1=-ΔH2
D.表示甲烷燃烧热的热化学反应方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-16b kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com