
【题目】CH3COONa溶于水电离得到的__________(填“CH3COO-”或“Na+”)结合水电离产生的______(填“OH-”或“H+”)使水的电离平衡向____(填“正向”或“逆向”)移动,使体系中c(H+)___c(OH-)(填“>”或“<”),使体系呈___(填“酸”或“碱”)性。
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A. 在强碱溶液中:Na+、K+、AlO2﹣、CO32﹣
B. 在pH=0的溶液中:K+、Fe2+、Cl﹣、NO3﹣
C. 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣
D. 在c(H+)=10﹣13mol/L的溶液中:NH4+、Al3+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入到盛有氯化镁溶液的试管里,不可能观察到的现象是 ( )
A.熔成小球并在液面上游动
B.有气体生成
C.溶液底部有银白色物质生成
D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L-1H3PO4溶液中加入NaOH的过程中各种微粒的物质的量分数随pH的变化关系如图所示(H3PO4)的三级电离常数依次为Ka1、Ka2、Ka3、pK=-lgK)。下列叙述错误的是

A. pKa1=2.16
B. 溶液呈中性时,[H2PO4-]>[HPO42-]
C. 反应PO43-+H2O![]() HPO42-+OH-的pK=1.68
HPO42-+OH-的pK=1.68
D. Na2HPO4溶液中存在[OH-]+[PO43-]=[H+]+[H2PO4-]+[H3PO4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl。
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲烷(CH4是一种可燃物)燃料电池技术方面获得新突破。甲烷燃料电池的工作原理如下图所示:
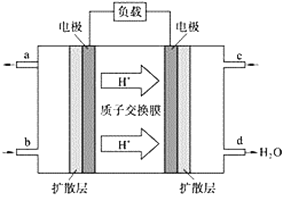
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式_________________________。
③工作一段时间后,当3.2 g甲烷完全反应生成CO2时,有__________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1)燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
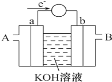
使用时,空气从_______口通入(填“A”或“B”);
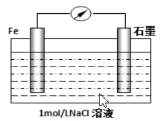
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则正极的电极反应式为:_________________,当导线中有3.01×1023个电子流过,被腐蚀的铁元素为_______g。[ 提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2 ]
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
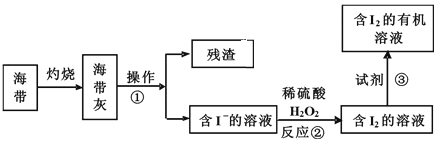
①中操作的名称是_______;下述物质中不可做试剂③的是________。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在空气中燃烧生成二氧化碳和水,下列说法正确的是( )
A.断裂H-O键放出能量B.形成H-O键吸收能量
C.该反应是放热反应D.该反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是
A. 质子数为17、中子数为20的氯原子:2017ClB. 次氯酸的结构式:H-Cl-O
C. 氯分子的电子式:![]() D. 氯乙烯分子的结构简式:H3C—CH2Cl
D. 氯乙烯分子的结构简式:H3C—CH2Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com