
ЁОЬтФПЁПвбжЊЗАЕФЛЏКЯЮядкЫЎШмвКжаДцдкЖржжРызгаЮЪНЃКV2+(зЯЩЋ)ЁЂV3+(ТЬЩЋ)ЁЂVO2+(РЖЩЋ)ЁЂVO2+ЃЈЛЦЩЋЃЉЁЂVO43-(ЮоЩЋ)ЁЂV5O143-(КьзиЩЋ)ЕШЁЃ
ЃЈ1ЃЉШчЙћЯђЫсадЕФVSO4ШмвКжаЕЮМгИпУЬЫсМиШмвКЃЌШмвКГіЯжЕФбеЩЋБфЛЏЪЧЃКзЯЩЋЁњТЬЩЋЃЈIЃЉЁњРЖЩЋЁњТЬЩЋЃЈЂђЃЉЁњЛЦЩЋЁЃдђГіЯжТЬЩЋЃЈIЃЉЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЪЧ_________________________ЁЃ
ЃЈ2ЃЉЯђЫсад(VO2)2SO4ШмвКжаМгШыNaOHШмвКЕїНкpHЃЌЫцзХNaOHШмвКЕФМгШы,ШмвКЯШГіЯжКьзиЩЋЃЌМЬајМгШыNaOHШмвК,зюжеБфЮЊЮоЩЋЁЃаДГі(VO2)2SO4ЩњГЩКьзиЩЋШмвК,КьзиЩЋШмвКБфЮЊЮоЩЋШмвКЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК___________________________________________________________ЁЃ
ЃЈ3ЃЉЯђVO2+ЕФШмвКжаМгШыАБЫЎПЩвдЕУЕНNH4VO3(ЮЂШмгкЫЎ)ЃЛNH4VO3ЪмШШзюжеЛсЗжНтЩњГЩЗАЕФбѕЛЏЮяЁЃ
ЂйЪвЮТЯТЃЌNH4VO3дкЫЎжаЕФKspЧњЯпШчЭМЂёЫљЪОЃЌдђЦфжЕЮЊ________ЁЃ
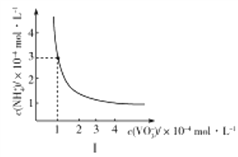
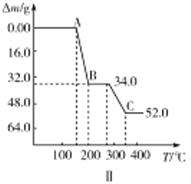
ЂкШШжиЗжЮіПЩЬНОПЛЏбЇБфЛЏЕФРњГЬЃЌФГбаОПаЁзщШЁ234gNH4VO3НјааЬНОПЃЌБКЩеЙ§ГЬжаЙЬЬхжЪСПЕФМѕаЁСПЫцЮТЖШЕФБфЛЏЧњЯпШчЭМЂђЫљЪО,дђBЕФЛЏбЇЪНЪЧ__________ЃЌCЕФЛЏбЇЪНЪЧ__________ЁЃ
ЃЈ4ЃЉвбжЊ2VO2++H2C2O4+2H+=2VO2++2CO2Ёќ+2H2OЁЃгУСђЫсЫсЛЏЕФH2C2O4ШмвКВтЖЈ(VO2)2SO4ШмвКжаЗАКЌСПЕФВНжшЮЊЃКШЁ10.0mL0.1molЁЄL-1H2C2O4ШмвКгкзЖаЮЦПжаЃЌНЋД§ВтвКЪЂЗХдкЕЮЖЈЙмжаЃЛЕЮЖЈЕНжеЕуЪБ,ЯћКФД§ВтвКЕФЬхЛ§ЮЊ10.0mLЃЎ
ЂйЪЧЗёашвЊМгШыжИЪОМС?________________ЁЃ
Ђк(VO2)2SO4ШмвКжаЗАЕФКЌСПЮЊ________gЁЄL-1ЁЃ
ЁОД№АИЁП 5V2++MnO4-+8H+=5V3++Mn2++4H2O 5VO2++8OH-=V5O143-+4H2O V5O143-+12OH-=5VO43-+6H2O 3ЁС10-8 HVO3 V2O5 ашвЊ 10.2
ЁОНтЮіЁПЃЈ1ЃЉV2+ОпгаЛЙдадЃЌБЛЫсадИпУЬЫсМиШмвКбѕЛЏЮЊV3+ЃЌЫљвдШмвКгЩзЯЩЋБфЮЊТЬЩЋЃЌV3+МЬајбѕЛЏЮЊVO2+ЃЌШмвКгжЯдРЖЩЋЃЌзюКѓVO2+МЬајБЛбѕЛЏЮЊVO2+ЃЌШмвКЯдЛЦЩЋЃЌдкЛЦЩЋКЭРЖЩЋжЎМфЛсГіЯжЙ§ЖШбеЩЋзДЬЌТЬЩЋЃЌетОЭЪЧЕкЖўДЮГіЯжТЬЩЋЕФдвђЃЌЕквЛДЮГіЯжТЬЩЋЖдгІЕФРызгЗНГЬЪНЮЊЃК5V2++MnO4-+8H+=5V3++Mn2++4H2O
ЃЈ2ЃЉГіЯжКьзиЩЋЪЧвђЮЊVO2+дкМюадЬѕМўжазЊБфГЩСЫV5O143-ЃЌЦфжаVдЊЫиЕФЛЏКЯМлУЛгаИФБфЃЌЫљвдЖдгІЕФРызгЗНГЬЪНЮЊЃК5VO2++8OH-=V5O143-+4H2O ЃЛ ШмвКгЩКьзиЩЋзЊЛЛЮЊЮоЩЋЃЌдђЪЧV5O143-дкЙ§СПМюЕФзїгУЯТзЊБфЮЊVO43-ЃЌЖдгІЕФРызгЗНГЬЪНЮЊЃКV5O143-+12OH-=5VO43-+6H2O
ЃЈ3ЃЉЂйNH4VO3(s ) ![]() NH4+(aq)+VO3-(aq)ЃЌ Ksp=c(NH4+)ЁСc(VO3-)=3ЁС10-4ЁС1ЁС10-4=3ЁС10-8 Ђк234gNH4VO3ЕФЮяжЪЕФСПn=234gЁТ117g/mol=2molЃЌДгAЕуЕНBЕуЃЌЮяжЪЕФжЪСПМѕЩй34gЃЌДгBЕуЕНCЕуЮяжЪЕФжЪСПМѕЩй52g-34g=18gЃЌИљОнзюКѓЕФВњЮяЮЊЗАЕФбѕЛЏЮяПЩжЊСНДЮМѕЩйЕФжЪСПЮЊNH3КЭH2OЕФжЪСПЃЌЩш1molNH4VO3ЗжНтЩњГЩЕФNH3КЭH2OЕФЮяжЪЕФСПЗжБ№ЮЊxЁЂyЃЌдђx=1mol ЃЌ3x+2y=4ЃЌЫљвдy=0.5mol ЃЌЫљвдNH4VO3ЗжНтЩњГЩЕФАБЦјКЭЫЎЕФжЪСПБШ=17:0.5ЁС18=34:18ЃЌЙЪAЕНBМѕЩйЕФЪЧNH3ЕФжЪСПЃЌЗжНтЩњГЩЕФАБЦјЕФжЪСПЮЊ34gЃЌМД2molЃЌЫљвдNH4VO3гыЩњГЩЕФNH3ЕФЛЏбЇМЦСПЪ§БШР§ЮЊ1:1ЃЌИљОнжЪСПЪиКуПЩжЊЪЃгрЕФЛЏКЯЮяBЕФЛЏбЇЪНЮЊHVO3ЃЛ2mol HVO3ЪЇШЅЕФЫЎЕФжЪСПЮЊ18gЃЌМДЪЇШЅ1molЫЎЃЌИљОнжЪСПЪиКуПЩжЊЛЙЪЃгр2molVдзгКЭ5molOдзгЃЌЫљвдCЕФЛЏбЇЪНЮЊV2O5
NH4+(aq)+VO3-(aq)ЃЌ Ksp=c(NH4+)ЁСc(VO3-)=3ЁС10-4ЁС1ЁС10-4=3ЁС10-8 Ђк234gNH4VO3ЕФЮяжЪЕФСПn=234gЁТ117g/mol=2molЃЌДгAЕуЕНBЕуЃЌЮяжЪЕФжЪСПМѕЩй34gЃЌДгBЕуЕНCЕуЮяжЪЕФжЪСПМѕЩй52g-34g=18gЃЌИљОнзюКѓЕФВњЮяЮЊЗАЕФбѕЛЏЮяПЩжЊСНДЮМѕЩйЕФжЪСПЮЊNH3КЭH2OЕФжЪСПЃЌЩш1molNH4VO3ЗжНтЩњГЩЕФNH3КЭH2OЕФЮяжЪЕФСПЗжБ№ЮЊxЁЂyЃЌдђx=1mol ЃЌ3x+2y=4ЃЌЫљвдy=0.5mol ЃЌЫљвдNH4VO3ЗжНтЩњГЩЕФАБЦјКЭЫЎЕФжЪСПБШ=17:0.5ЁС18=34:18ЃЌЙЪAЕНBМѕЩйЕФЪЧNH3ЕФжЪСПЃЌЗжНтЩњГЩЕФАБЦјЕФжЪСПЮЊ34gЃЌМД2molЃЌЫљвдNH4VO3гыЩњГЩЕФNH3ЕФЛЏбЇМЦСПЪ§БШР§ЮЊ1:1ЃЌИљОнжЪСПЪиКуПЩжЊЪЃгрЕФЛЏКЯЮяBЕФЛЏбЇЪНЮЊHVO3ЃЛ2mol HVO3ЪЇШЅЕФЫЎЕФжЪСПЮЊ18gЃЌМДЪЇШЅ1molЫЎЃЌИљОнжЪСПЪиКуПЩжЊЛЙЪЃгр2molVдзгКЭ5molOдзгЃЌЫљвдCЕФЛЏбЇЪНЮЊV2O5
ЃЈ4ЃЉЂйвђЮЊЗДгІЩњГЩЕФVO2+ГЪРЖЩЋЃЌМгШыЕФVO2+ГЪЛЦЩЋЃЌгЩгкРЖЩЋгыЛЦЩЋжЎМфгаТЬЩЋЕФЙ§ЖЩЬЌЃЌЕБЕЮЖЈДяЕНжеЕуЪБЮоЗЈУїЯдЙлВьЕНШмвКбеЩЋЕФБфЛЏЃЌЙЪашвЊМгШывЛжжФмгыВнЫсЯдЩЋЕФЮяжЪЃЌЕБВнЫсЗДгІЭъЃЌбеЩЋЯћЪЇЃЌМДДяЕНЕЮЖЈЕФжеЕуЃЌЙЪашвЊМгШыжИЪОМСЃЛЂкИљОнЗНГЬЪНгаVO2+ЕФЮяжЪЕФСПn=2ЁС10ЁС10-3ЁС0.1=2ЁС10-3ЃЈmolЃЉЃЌЫљвдVдЊЫиЕФжЪСПЮЊ2ЁС10-3mol ЁС51g/mol=102ЁС10-3gЃЌЙЪ (VO2)2SO4ШмвКжаЗАЕФКЌСПЮЊ102ЁС10-3gЁТ(10ЁС10-3L)=10.2 gЁЄL-1



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђ100mL FeI2ШмвКжаж№НЅЭЈШыC12,Цфжаn(I2)ЁЂn(Fe3+)ЫцЭЈШыn(C12)ЕФБфЛЏШчЭМЫљЪО,ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. бѕЛЏадЧПШѕ:I2<Fe3+
B. n(Cl2)=0.12molЪБ,ШмвКжаЕФРызгжївЊгаFe2+ЁЂFe3+ЁЂClЁЅ
C. гЩЭМПЩжЊ,ИУFeI2ШмвКЕФХЈЖШЮЊ1molЁЄ L-l
D. n(C12):n(FeI2)=1:2ЪБ,ЗДгІЕФРызгЗНГЬЪНЮЊ:2Fe2++Cl2=2Fe3++2Cl-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДЮСзЫс(H3PO2)ЪЧвЛжжОЋЯИСзЛЏЙЄВњЦЗЃЌЪєгквЛдЊШѕЫсЃЌОпгаНЯЧПЕФЛЙдадЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
A. H3PO2ШмгкЫЎЕФЕчРыЗНГЬЪНЮЊЃКH3PO2![]() H++H2PO2-
H++H2PO2-
B. H3PO2гыЙ§СПNaOHШмвКЗДгІЕФРызгЗНГЬЪНЮЊЃКH3PO2+3OH-ЈTPO23-+3H2O
C. НЋH3PO2ШмвКМгШыЕНЫсадИпУЬЫсМиШмвКжаЃЌH3PO2ЕФЛЙдВњЮяЮЊH3PO4
D. гУЖшадЕчМЋЕчНтNaH2PO2ШмвКЃЌЦфбєМЋЗДгІЪНЮЊЃК2H2O-4e-ЈTO2Ёќ+4H+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЗВЪЧгаЛЏбЇМќЖЯСбЕФБфЛЏвЛЖЈЪЧЛЏбЇБфЛЏ
B. ЮќШШЗДгІвЛЖЈашвЊМгШШВХФмЗЂЩњ
C. КЌЙВМлМќЕФЛЏКЯЮявЛЖЈЪЧЙВМлЛЏКЯЮя
D. ЛюЦУЕФН№ЪєгыЛюЦУЕФЗЧН№ЪєдЊЫивВПЩвдаЮГЩЙВМлЛЏКЯЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзЁЂввСНжжЗЧН№ЪєБШНЯЃЌФмЫЕУїМзБШввЕФЗЧН№ЪєадЧПЕФЪЧЃЈ ЃЉ
ЂйМзБШввИќШнвзгыH2ЛЏКЯЂкМзЕЅжЪФмгыввЕФвѕРызгЗДгІЃЌжУЛЛГіввЕЅжЪЂлМзЕФЦјЬЌЧтЛЏЮяБШввЕФЦјЬЌЧтЛЏЮяЮШЖЈЂмгыФГН№ЪєЗДгІЪБМздзгЕУЕчзгЪ§БШввЕУЕФЖрЂнМзЕЅжЪЕФШлЗаЕуБШввЕФЕЭ
A. Ђм B. Ђн C. ЂйЂкЂл D. ЂйЂкЂлЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧАЫФжмЦкдЊЫиAЁЂBЁЂCЁЂDЁЂEЕФдзгађЪ§вРДЮдіДѓЃЌЛљЬЌAдзгКЫЭтЕчзгеМОн3ИіЙьЕРЃЌЛљЬЌBдзгКЫЭтЕчзгеМОн3ИіФмМЖЧвУПИіФмМЖЩЯЕчзгЪ§ЯрЕШЃЌCЕФЫЋдзгЕЅжЪЗжзгжаІвМќКЭІаМќЪ§ФПжЎБШЮЊ1:2ЃЌDЕФзюИпе§ЛЏКЯМлКЭзюЕЭИКЛЏКЯМлжЎКЭЕШгк4ЃЛЛљЬЌEдзгКЫЭтга6ИіЮДГЩЖдЕчзгЁЃ
ЃЈ1ЃЉЛљЬЌEдзгЕФКЫЭтЕчзгХХВМЪНЮЊ______ЃЛЛљЬЌDдзгКЫЭтЕчзгеМОнЕФФмСПзюИпЕФФмМЖЗћКХЮЊ_____________ЁЃ
ЃЈ2ЃЉAдЊЫиЕФИїМЖЕчРыФмШчЯТЃК
ФмМЖ(I) | I1 | I2 | I3 | I4 | I5 |
ЕчРыФм/kJЁЄmol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
ЗжЮіЩЯБэЪ§ОнжЊЃЌЯрСкСНИіЕчзгЕФЕчРыФмжаЃЌI3КЭI4жЎМфВювьзюДѓЃЌЦфжївЊдвђЪЧ__________ЁЃ
ЃЈ3ЃЉAЁЂBЁЂCдЊЫиЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЫсадвРДЮдіЧПЃЌЦфдвђЪЧ________ЁЃ
ЃЈ4ЃЉТШдЊЫигыAЁЂBЁЂCдЊЫизщГЩЕФЙВМлЗжзгACl3ЁЂBCl4ЁЂCCl3жаЃЌжааФдзгВЩгУsp3дгЛЏЁЂСЂЬхЙЙаЭЮЊШ§НЧзЖаЮЕФЪЧ_______(ЬюЗжзгЪН)ЁЃ
ЃЈ5ЃЉ(DC)4ЮЊШШЩЋадЙЬЬхЃЌЧвгаЩЋЮТаЇгІЁЃЕЭгк-30ЁцЪБЮЊЕЛЦЩЋЃЌЪвЮТЯТЮЊГШЛЦЩЋЃЌИпгк100ЁцЪБЮЊЩюКьЩЋЁЃдкЕЛЦЩЋЁњГШЛЦЩЋЁњЩюКьЩЋЕФзЊЛЏжаЃЌЦЦЛЕЕФзїгУСІЪЧ____ЃЛдкГЃбЙЯТЃЌ(DC)4Ипгк130ЁцЗжНтЮЊЯргІЕФЕЅжЪЃЌетвЛБфЛЏжаЦЦЛЕЕФзїгУСІЪЧ_______ЁЃдкBЁЂCЁЂDЕФМђЕЅЦјЬЌЧтЛЏЮяжаЃЌЪєгкЗЧМЋадЗжзгЕФЪЧ______(ЬюЗжзгЪНЃЌЯТЭЌ)ЃЌГЃгыCu2+ЁЂZn2+ЁЂAg+ЕШаЮГЩХфРызгЕФЪЧ_______________ЁЃ
ЃЈ6ЃЉAЁЂCаЮГЩСЂЗНОЇЬхЃЌОЇЬхНсЙЙРрЫЦН№ИеЪЏЃЌШчЭМЫљЪОЁЃвбжЊЃКИУОЇЬхУмЖШЮЊІбgЁЄЉM-3ЃЌNAДњБэАЂЗќйЄЕТТоГЃЪ§ЕФжЕЁЃ

ЂйИУОЇЬхЕФЛЏбЇЪНЮЊ__________ЁЃ
ЂкдкИУОЇЬхжаЃЌAгыCаЮГЩЙВМлМќЕФМќГЄ(d)ЮЊ_____pmЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЮЭтЛюЖЏаЁзщЩшМЦШчЭМЪЕбщзАжУЃЌбщжЄЁАЖўбѕЛЏЬМгыЫЎНгДЅЪБВХФмКЭЙ§бѕЛЏФЦЗДгІЁБЃЎ
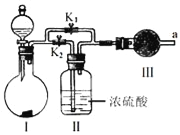
ЃЈ1ЃЉЙ§бѕЛЏФЦгыЫЎЗДгІЕФЛЏбЇЗНГЬЪНЪЧ__ЃЎ
ЃЈ2ЃЉзАжУIЪЧжЦБИДПОЛЕФ__ЃЈЬюЛЏбЇЪНЃЉЃЎдђзАжУIжазюЪЪвЫЕФЪдМСзщКЯЪЧ__ЃЈЬюзжФИЃЉЃЎ
aЃЎЯЁбЮЫс bЃЎЯЁСђЫс cЃЎаЁЫеДђ dЃЎЪЏЛвЪЏ
ЃЈ3ЃЉЪЕбщЪБЃЌгІЯШДђПЊЕЏЛЩМаK2ЃЌЙиБеK1ЃЌЙлВьЕНдЄЦкЯжЯѓКѓЃЌДђПЊK1ЃЌдйЙиБеK2ЃЎ
ЃЈ4ЃЉЪЕбщЙ§ГЬжаНЋДјЛ№аЧЕФФОЬѕжУгкaПкЃЌЙлВьЕНДјЛ№аЧЕФФОЬѕЪМжеВЛИДШМЃЎ
ЂйЮЊЙлВьЕНзюжеФОЬѕИДШМЃЌМзНЈвщдкЂѓКѓАВзАвЛИіЪЂгаМюЪЏЛвЕФИЩдяЙмЃЌФПЕФЪЧ__ЃЛ
ЂкввШЯЮЊМДЪЙВЩФЩМзЕФНЈвщЧвзюжеЙлВьЕНФОЬѕИДШМЃЌвВВЛФмжЄУїCO2ВЮгыСЫЗДгІЃЌдвђЪЧ__ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІдкШЮвтЮТЖШЯТвЛЖЈФмздЗЂНјааЕФЪЧЃЈ ЃЉ
A.2NaCl+2H2O ![]() 2NaOH+Cl2Ёќ+H2Ёќ
2NaOH+Cl2Ёќ+H2Ёќ
B.NH3ЃЈgЃЉ+HClЃЈgЃЉЈTNH4ClЃЈsЃЉЁїHЃМ0
C.CaCO3ЃЈsЃЉЈTCaOЃЈsЃЉ+CO2ЃЈgЃЉЁїHЃО0
D.X2Y2ЃЈsЃЉЈTX2ЃЈgЃЉ+Y2ЃЈgЃЉЁїHЃМ0
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРызгЗНГЬЪНжа,е§ШЗЕФЪЧ
A. аЁЫеДђШмвКгыЩйСПГЮЧхЪЏЛвЫЎЛьКЯ:Ca2++0H-+HCO3-=CaCO3Ё§+H2O
B. ЯђSiO2ЗлФЉжаМгШЫзуСПЕФNaOHШмвК:SiO2+2OH-=Si032-+H2O
C. ЯђAlCl3ШмвКжаМгШЫзуСПЕФАБЫЎ:A13++40H-=AlO2-+2H2O
D. НЋТШЦјЭЈШыЫЎжа:Cl2+H2O=Cl-+ClO-+2H+
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com