
下列化学用语的书写,正确的是
A.氮气的电子式: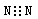 B.硫离子的结构示意图:
B.硫离子的结构示意图: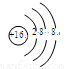
C.溴化钠的电子式: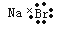 D.水分子的球棍模型:
D.水分子的球棍模型: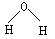
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:填空题
(11分)下表是元素周期表短周期的一部分
① |
|
| ||||||
|
|
|
| ② | ③ |
| ④ |
|
| ⑤ | ⑥ | ⑦ |
|
|
|
| |
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g)  2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新 达到平衡后,A2B的物质的量
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新 达到平衡后,A2B的物质的量
A.小于0.15 mol B.等于0.3 mol
C.等于0.15 mol D.大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列说法中错误的是
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
D.需要加热才能发生的化学反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H+、NO3—、Fe2+、Na+ B.Ag+、NO3—、C1—、K+
C.K+、Ba2+、OH—、SO42— D.Cu2+、NH4+、Br—、OH—
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三第三次调研测试化学试卷(解析版) 题型:填空题
(14 分) 一氧化碳被广泛应用于冶金工业和电子工业。
⑴高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s) △H=a kJ·mol-1
CO(g)+3Fe2O3(s)=CO2(g)+2Fe3O4(s) △H=b kJ·mol-1
反应3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)的△H= kJ·mol-1(用含a、b 的代数式表示)。
⑵电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g) +CO(g) △H>0
CH3OH(g) +CO(g) △H>0
①第一步反应的机理可以用下图表示:
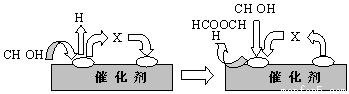
图中中间产物X的结构简式为 。
②在工业生产中,为提高CO的产率,可采取的合理措施有 。
⑶为进行相关研究,用CO还原高铝铁矿石,反应后固体物质的X—射线衍射谱图如图所示(X—射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。反应后混合物中的一种产物能与盐酸反应生产两种盐,该反应的离子方程式为 。

⑷某催化剂样品(含Ni2O340%,其余为SiO2)通过还原、提纯两步获得镍单质:首先用CO将33.2 g样品在加热条件下还原为粗镍;然后在常温下使粗镍中的Ni与CO结合成Ni(CO)4(沸点43 ℃),并在180 ℃时使Ni(CO)4重新分解产生镍单质。
上述两步中消耗CO的物质的量之比为 。
⑸为安全起见,工业生产中需对空气中的CO进行监测。
①粉红色的PdCl2溶液可以检验空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀。每生成5.3gPd沉淀,反应转移电子数为 。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如图所示。这种传感器利用原电池原理,则该电池的负极反应式为 。

查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三第三次调研测试化学试卷(解析版) 题型:选择题
下列依据相关实验得出的结论正确的是
A.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
B.纤维素的水解产物能够发生银镜反应,说明纤维素是一种还原性糖
C.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42-
D.等物质的量浓度的H3PO4溶液的pH比H2SO4溶液大,说明硫比磷的非金属性强
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三5月信息卷化学试卷(解析版) 题型:实验题
(12分)碱式碳酸镁[一般以xMgCO3?yMg(OH)2?zH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:

(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是: 。
②氢氧化镁浆液与CO2反应的化学方程式为:
。
③碱式碳酸镁用乙醇洗涤的目的是: 。
(2)已知:碱式碳酸镁分解反应方程式为:
xMgCO3?yMg(OH)2?zH2O 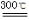 (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O
某同学将46.6g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为20.0g,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重17.6g。根据实验测定的数据,确定碱式碳酸镁[xMgCO3·yMg(OH)2?zH2O]的化学式(要求写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省泰州市姜堰区高二下学期期中考试 化学试卷(解析版) 题型:实验题
(12分)某化学兴趣小组用如下图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
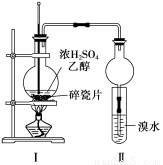

图1 图2
(1)写出该实验中生成乙烯的化学方程式 。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 。
a.乙烯与溴水易发生取代反应
b.使溴水褪色的反应,未必是加成反应
c.使溴水褪色的物质,未必是乙烯
(3)乙同学经过细致观察后试管中另一现象后并借用pH试纸测定,证明反应中有乙烯生成,请简述
。
(4)丙同学对上述实验装置进行了改进,在Ⅰ和Ⅱ之间增加上图2装置以除去乙醇蒸气和SO2,则A中的试剂是 ,B中的试剂为 。
(5)处理上述实验后烧瓶中废液的正确方法是 。
a.冷却后倒入下水道中 b.冷却后倒入空废液缸中 c.冷却后加水稀释,倒入废液缸中,加废碱中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com