
 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
|
| 0.1mol |
| 0.1mol+0.1mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
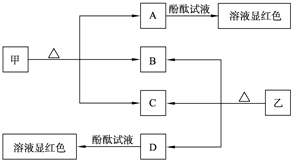
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石雕像被酸雨腐蚀毁坏 |
| B、充有氢气的气球遇明火爆炸 |
| C、铁制菜刀生锈 |
| D、铜铸塑像上出现铜绿[Cu2 (OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①④ | D、③ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
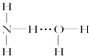
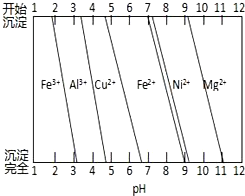
| A、①③ | B、②③ | C、⑤⑥ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
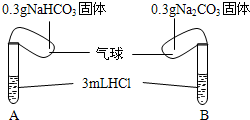 Ⅰ.化学课上老师演示了如图的实验:
Ⅰ.化学课上老师演示了如图的实验:| 序号 | 试剂1 | 试剂2 | 混合前 温度 | 混合后温度 |
| ① | 35mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| ② | 35mL水 | 3.2Na2CO3固体 | 20℃ | 24.3℃ |
| ③ | 35mL稀盐酸 | 含2.5g NaHCO3的饱和溶液32.5mL | 20℃ | 19℃ |
| ④ | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶液23.1mL+10ml水 | 20℃ | 24.2℃ |
| ⑤ | 35mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
| ⑥ | 35mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、以X浓度变化表示的反应速率为0.06mol/(L?min) | ||
B、将容器体积变为20L,Z的平衡浓度为原来的
| ||
| C、平衡时,X的转化率为30% | ||
| D、起始状态和平衡时容器内的气体压强比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com