

���� ��1��S��ԭ�ӽṹ��3�����Ӳ㣬����������Ϊ6��H2Te��H2S����Է���������ķе�ߣ���ˮ�к������
��2����SO3�м۵��Ӷ�Ϊ3��û�й¶Ե��ӣ�Ϊƽ�������Σ���SO2�м۵�����Ϊ3���¶Ե�����Ϊ1��ΪV�ͣ�
��ͼ1�й�̬SO3��Sԭ���γ�4�����۵�����
��3����������Cu��2��S������������ÿ��Cuԭ����4��S��������Ϧ�=$\frac{m}{V}$���㣮
��� �⣺��1��S��ԭ�ӽṹ��3�����Ӳ㣬����������Ϊ6��λ�ڵڢ�A�壬H2Te��H2S����Է���������ķе�ߣ���H2Te�е�ߣ�H2O��H2Te�е�ߵ�ԭ�������߾�Ϊ���Ӿ��壬H2O�����д��������
�ʴ�Ϊ����A�����߾�Ϊ���Ӿ����ҽṹ���ƣ�H2Te��Է���������H2S���Ӽ���������ǿ�����߾�Ϊ���Ӿ��壬H2O�����д��������
��2����SO3�м۵��Ӷ�Ϊ3��û�й¶Ե��ӣ�Ϊƽ�������Σ���SO2�м۵�����Ϊ3���¶Ե�����Ϊ1��ΪV�ͣ���
A������ԭ�ӵļ۲���Ӷ���Ŀ��ȣ���A��ȷ��
B�����������ǷǼ��Է��ӣ���B����
C������ԭ�ӵŶԵ�����Ŀ���ȣ���C����
D��������S��O֮��ļ��Լ�����D��ȷ��
�ʴ�Ϊ��AD��
��ͼ1�й�̬SO3��Sԭ���γ�4�����۵��������ӻ����������sp3���ʴ�Ϊ��sp3��
��3����������Cu��2��S������������ÿ��Cuԭ����4��S������8��S�������ڣ��ɻ�ѧʽΪCuFeS2����������Ϊ $\frac{4��184g/mol}{N{\;}_{A}}$����������a=0.524nm��c=1.032nm�����Ϊ��0.524��10-7cm��2��1.032��10-7cm����=$\frac{m}{V}$=$\frac{4��184g/mol}{6.02��10{\;}^{23}mol{\;}^{-1}����0.524��1{0}^{-7}cm��^{2}��1.032��1{0}^{-7}cm}$=4.31g•cm-3��
�ʴ�Ϊ��4�� 4.31��
���� ���⿼�龧�����㼰�ӻ��ȣ�Ϊ�߿��������ͺ�Ƶ���㣬������ѧ���ķ��������Ŀ��飬�������ʽṹ�����ʡ������ṹ�������Ϊ������Ĺؼ�����Ŀ�ѶȽϴ�


 ��ҵ����ϵ�д�
��ҵ����ϵ�д� ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
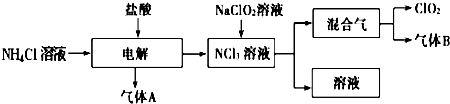
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��װ�ó�ȥ���������л��е��������� | |
| B�� |  ��װ�ó�ȥ�����е������Ȼ��� | |
| C�� | 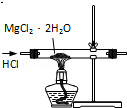 ��װ����ȡ��ˮMgCl2 | |
| D�� |  ��װ����ȡ��ϩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
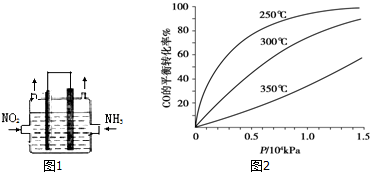
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

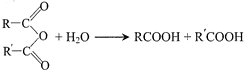
 ��G
��G

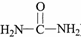 ����ԭ���ϵ���ԭ�ӿ�����A�ϵ���ԭ��������C�����ӳɷ�Ӧ�������۳ɸ߷��ӻ����д��������C��һ���������������Ը߷��ӻ�����Ļ�ѧ����ʽ
����ԭ���ϵ���ԭ�ӿ�����A�ϵ���ԭ��������C�����ӳɷ�Ӧ�������۳ɸ߷��ӻ����д��������C��һ���������������Ը߷��ӻ�����Ļ�ѧ����ʽ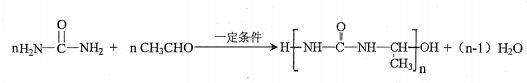
 ����һ�֣�
����һ�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
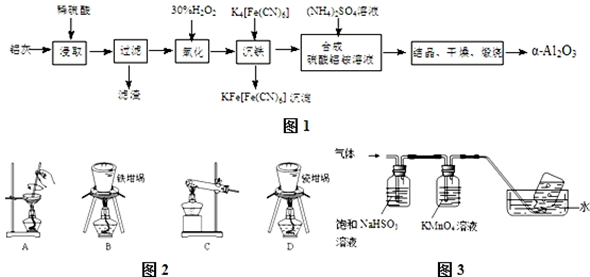
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
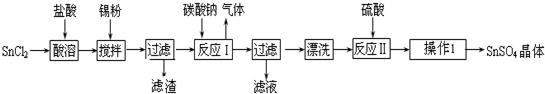
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com