

分析 (1)据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g)的反应热;
(2)通入甲醇的一级为负极,发生氧化反应,通入氧气的一级为正极,发生还原反应,甲醇在碱性条件下被氧化生成碳酸根离子和水;
(3)阳极发生氧化反应Co2+氧化成Co3+,以Co3+做氧化剂把水中的甲醇氧化成CO2,同时生成Co2+.
解答 解:(1)已知:反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ•mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ•mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ•mol-1,
故答案为:-75.60 kJ•mol-1;
(2)通入氧气的一级为正极,发生还原反应,甲醇在碱性条件下与氧气反应生成碳酸钾和水,总方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,
故答案为:正;2CH3OH+3O2+4KOH=2K2CO3+6H2O;
(3)阳极发生氧化反应Co2+氧化成Co3+,电极方程式为Co2+-e-=Co3+,以Co3+做氧化剂把水中的甲醇氧化成CO2,同时生成Co2+,离子方程式为6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+,
故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+.
点评 本题综合性较大,涉及热化学方程式以及电化学知识等,为高考常见题型,侧重于学生的分析、计算能力的考查,难度中等,注意电极方程式的书写以及盖斯定律的运用.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
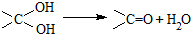 .有机物
.有机物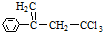 是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )
是选择性内吸传导性除草剂,俗称稗草烯,主要用于水稻田防除稗草.下列有关该有机物的说法错误的是( )| A. | 能使酸性高锰酸钾溶液褪色 | |
| B. | 可用 与Cl2在光照条件下通过取代反应获得较纯的该物质 与Cl2在光照条件下通过取代反应获得较纯的该物质 | |
| C. | 在碱性条件下充分水解,可生成羧酸钠 | |
| D. | 在一定条件下可发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
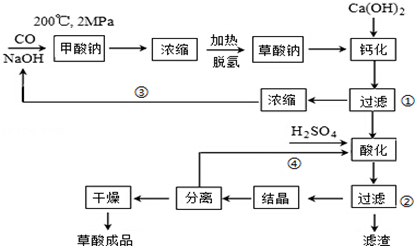
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
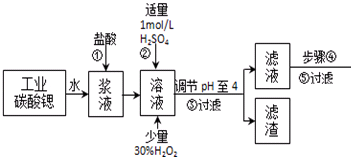
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
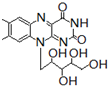
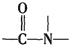 +H2O$→_{△}^{H+}$
+H2O$→_{△}^{H+}$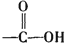 +
+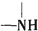 ,有关核黄素的下列说法中,正确的是( )
,有关核黄素的下列说法中,正确的是( )| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质Ag2SO4的饱和溶液中,若c(SO42-)=amol•L-1,则Ksp(Ag2SO4)=2a3 | |
| B. | 某氨水的pH=11,将此溶液稀释10倍后,溶液的pH<10 | |
| C. | Ka(HCN)<Ka(CH3COOH),说明相同温度下同浓度的HCN溶液的酸性比CH3COOH溶液的强 | |
| D. | pH=8的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 门捷列夫利用软锰矿和浓盐酸反应制得了氯气 | |
| B. | 利用火力发电厂及核电站用于冷却的循环海水来提取单质溴以减少能耗 | |
| C. | 含重金属离子的污水的排放产生“赤潮”或“水华”等水污染现象 | |
| D. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com