
【题目】20 ℃时,饱和NaCl溶液的密度为ρg·cm-3,物质的量浓度为c mol·L-1,则下列说法中不正确的是
A.温度低于20 ℃时,饱和NaCl溶液的浓度小于c mol·L-1
B.此溶液中NaCl的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于ρg·cm-3的NaCl溶液是不饱和溶液
D.20 ℃时,饱和NaCl溶液的溶解度S=![]() g
g
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某温度时,在2 L容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:

(1)在4 min末时,A、B的物质的量浓度c(A)________c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为________。
(3)该反应的化学方程式为__________________。
Ⅱ.将等物质的量的A、B混合放于2 L的密闭容器中,发生反应3A(g)+B(g)==X C(g)+2D(g)。经5 min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,v(C)=0.1 mol·L-1·min-1。
则:(1)X=________。
(2)前5 min内B的反应速率v(B)=________。5 min时A的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:

(1)在制备过程中,不但要将块状固体原料粉碎、磨成粉末,作用是_____________。
(2)在合成池里生成Fe3O4的离子方程式为_____________。
(3)根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近_____________。
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如右图(夹持装置略,气密性已检验):

操作步骤如下:
Ⅰ.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是_ ,烧杯中的现象是 ,相应的方程式是_ ___、___ _。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是 。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验某卤代烃(R-X)中的 X 元素,下列操作:(1)加热煮沸;(2)加入 AgNO3 溶液;(3)取少量该卤代烃;(4)加入足量稀硝酸酸化;(5)加入 NaOH 溶液;(6)冷却。正确的操作顺序是( )
A. (3) (1) (5) (6) (2) (4) B. (3) (5) (1) (6) (2) (4)
C. (3) (2) (1) (6) (4) (5) D. (3) (5) (1) (6) (4) (2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g) ![]() 2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度,反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度,反应速率随时间的变化关系如图所示。下列说法中正确的是

A.8min时表示正反应速率等于逆反应速率
B.前20minA的反应速率为0.05mol/(L·min)
C.反应方程式中的x=1,30min时表示增大压强
D.40min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。


(1)仪器a的名称为 ,仪器b中装入的试剂可以是 。
(2)按气流方向正确的装置连接顺序为(填序号,装置可重复使用): 。
(3)装置C的作用: 。
(4)实验结束时,应首先 (填序号);这样做的原因是 。
Ⅰ.熄灭A装置的酒精灯 Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为 。
(6)若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为 (用含x、y、m、n的式子表示)。
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2Al(s)+O2(g)=Al2O3(s) △H=-1644.3kJ·mol-1
2Fe(s)+O2(g)=Fe2O3(s) △H=-815.88kJ·mol-1
写出铝粉与氧化铁粉末发生铝热反应的热化学方程式 。
(2)高铁酸钾(K2FeO4)在水中的反应为4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。
4Fe(OH)3+8OH-+3O2。图1是25℃时K2FeO4在不同pH溶液中浓度的变化情况,图2是K2FeO4在不同温度时溶液浓度的变化情况。

①pH=4.74时,反应从开始到800min时平均反应速率v(OH-)= 。
②图1在800min后,三种溶液中的c(FeO42-)均不再改变。随着pH的变大,此反应的平衡常数K (填“变大”、“变小”或“不变”)。
③图2在240min后,四种溶液中FeO42-的浓度不再变化,下列说法正确的是
a.上述反应的△H>0 b.升高温度,该反应pH减小
c.温度越高,反应速率越慢 d.加入盐酸,FeO42-的浓度减小
④FeO42-在水溶液中的存在形态如图3所示。下列说法正确的是

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐变大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO4-+OH-=FeO42-+H2O
⑤高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
已知:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2,K2FeO4在处理水的过程中所起的作用是 。
(3)常温常压下,饱和氯水中氯气总浓度约为0.09mol/L,且存在可逆反应:Cl2 + H2O ![]() HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O
HCl + HClO,实验测得约有三分之一的氯气与水发生了反应。反应Cl2+H2O![]() HCl+HClO的平衡常数为 。
HCl+HClO的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
A. B.
B. C.
C.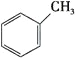
上述有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,
写出苯与溴发生反应的化学方程式___________________,
Ⅱ.下列几组物质中,互为同位素的有____________,
互为同素异形体的有___________,
互为同系物的有____________,
互为同分异构体的有____________,
属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]()
④ 和
和
⑤CH3(CH2)2CH3和(CH3)2CHCH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是一种重要的化工原料,工业上利用明矾石制备无水氯化铝的流程如下,请回答下列问题:

(1) 实验室中,可制得Cl2的组合是____________(填代号)。
①MnO2和浓盐酸混合共热 ②MnO2、NaCl和浓硫酸混合共热
③NaClO和盐酸混合共热 ④漂白粉和硫酸混合共热
(2) 吸收焙烧炉中产生的尾气,下列装置合理的是___________(填代号)。

(3)写出氧化炉中反应的化学方程式_____________。
(4)生产氯化铝的过程中焙烧炉和氯化炉中产生的SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少污染。试设计简单实验检验二者是否恰好完全反应,简要描述实验步骤、现象和结论_____________(仪器自选)。
可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氣化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(5)某同学设计用如下装置验证二氧化硫的某些化学性质。

① 能说明二氧化硫具有氧化性的实验现象为____________。
② 写出a瓶中发生反应的离子方程式________________。
③ 充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色。
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去。
实验III:向第三份溶液中加人BaCl2溶液,生成白色沉淀。
上述实验中能充分证明二氧化硫具有还原性的是__________(填实验代号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com