
【题目】Ⅰ.根据结构对有机物进行分类,有助于对其性质的掌握。
A. B.
B. C.
C.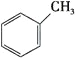
上述有机物属于芳香烃的是____________ (填字母),它与苯的关系是____________,
写出苯与溴发生反应的化学方程式___________________,
Ⅱ.下列几组物质中,互为同位素的有____________,
互为同素异形体的有___________,
互为同系物的有____________,
互为同分异构体的有____________,
属于同种物质的有____________。
①O2和O3 ②35Cl和37Cl
③![]() 和
和![]()
④ 和
和
⑤CH3(CH2)2CH3和(CH3)2CHCH3
⑥乙醇(CH3CH2OH)和甲醚(CH3OCH3)
【答案】Ⅰ.(1)C 同系物 ![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
Ⅱ.②;①;③;⑤⑥;④
【解析】
试题分析:Ⅰ.(1)芳香烃分子中只含有碳氢元素,且含有苯环,选项中a、b都不含苯环,只有c属于芳香烃,答案选C;C为甲苯,与苯结构相似,分子组成上相差CH2原子团,两者互为同系物;苯与液溴在FeBr3作催化剂的条件发生取代反应生成溴苯和HBr,反应的化学方程式为 ![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
Ⅱ.具有相同质子数不同中子数的核素互称为同位素,所以②互为同位素。由同一种元素形成的性质不同单质,互称为同素异形体,因此①互为同素异形体。结构相似分子组成相差若干个CH2原子团的物质互称为同系物,③互为同系物。分子式相同而结构不同的化合物互称为同分异构体,⑤⑥互为同分异构体。结构和性质均相同的,是同一种物质,④属于同一种物质。


科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和NaCl溶液的密度为ρg·cm-3,物质的量浓度为c mol·L-1,则下列说法中不正确的是
A.温度低于20 ℃时,饱和NaCl溶液的浓度小于c mol·L-1
B.此溶液中NaCl的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于ρg·cm-3的NaCl溶液是不饱和溶液
D.20 ℃时,饱和NaCl溶液的溶解度S=![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(T℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,该温度下水的KW= 。该温度(填“大于”、“小于”或“等于”) 25℃,其理由是 。
此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va:Vb= 。
(2)若所得混合溶液为中性,且a+b=12,则Va:Vb= 。
(3)若所得混合溶液的pH=10,且a=12,b=2,Va:Vb= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是

A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.乙醇和是乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔高
C..乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。
仪器a的名称是____________;其中发生反应的化学方程式为_______________。实验中为保证NaHCO3分解完全需加热至恒重,判断方法是________________。
⑵方案二:称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,待沉淀后,过滤,洗涤,干燥,称量固体质量,计算。
写出NaHCO3与足量Ba(OH)2溶液反应的离子方程式_______________;实验中判断沉淀是否完全的方法是______________。过滤操作中,除烧杯、漏斗外,还要用到的玻璃仪器为____________。
(3)方案三:称取一定质量样品,按如图装置进行实验:

B装置内所盛试剂是;D装置的作用是______________。实验前称取17.9g样品,实验后测得C装置增重8.8g,则样品中NaHCO3的质量分数为________。某同学认为上述测定结果__________(填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com