
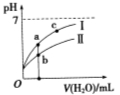
已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
C(Na+)>C(ClO—)>C(CH3COO—)>C(OH—)>C(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO—+CO2+H2O═2HClO+CO32—
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图像中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
C
【解析】
试题分析:A、醋酸的酸性强于次氯酸,所以相同浓度的CH3COONa和NaClO的混合溶液中,水解程度CH3COO-< ClO—,溶液中离子浓度的大小关系是C(Na+)>C(CH3COO—) >C(ClO—) >C(OH—)>C(H+),错误;B、由所给电离平衡常数可知酸性H2CO3> HClO> HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO—+CO2+H2O=HClO+HCO3—,错误;C、a、b、c三点所示溶液中氢离子浓度的大小关系是b>a>c,氢离子浓度越大,使水的电离平衡逆向移动,水的电离程度越小,所以水的电离程度c>a>b,正确;D、醋酸的酸性比次氯酸强,所以加入相同体积的水时醋酸的pH小于次氯酸,所以Ⅰ表示HClO,Ⅱ表示CH3COOH,溶液的导电性与溶液中的离子浓度有关,离子浓度越大,导电性越强,所以溶液导电性: b>a>c,错误,答案选C,
考点:考查水解程度的判断,酸性的比较,水电离程度的比较,对图像的分析能力


科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:填空题
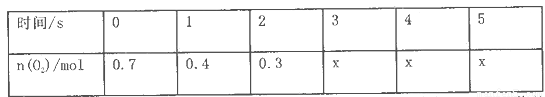
(10分)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应: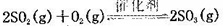 (正反应放热)。测得n(O2)随时间的变化如下表
(正反应放热)。测得n(O2)随时间的变化如下表
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22. 4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0-ls内该反应的平均反应速率为__________________。
(2)O2的平衡浓度c (O2)=____________________________;
(3) 4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是________(用百分数表示)。
(5)若将平衡混台气体中SO3的5%通入过量的BaCl2溶液,生成沉淀_______克(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
下列说法正确的是
A.汽油是纯净物,乙醇汽油是混合物
B.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃
C.糖类、蛋白质在一定条件下都能发生水解反应
D.乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为( )
1 | 2 | 3 | 4 | 5 | …… |
CH4 | C2H6 | C5H12 | C8H18 | …… | …… |
A.C14H30 B.C17H36 C.C20H42 D.C26H54
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省六市毕业班第二次联合调研检测理综化学试卷(解析版) 题型:填空题
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
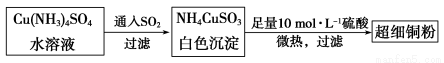
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②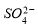 的空间构型为_____________,
的空间构型为_____________,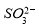 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 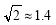 ,列式并计算结果)。
,列式并计算结果)。

查看答案和解析>>
科目:高中化学 来源:2013-2014河南省六市毕业班第二次联合调研检测理综化学试卷(解析版) 题型:选择题
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化学式为YX3,是一种刺激性气味的气体,乙是由X、Y、Z组成的盐。下列说法正确的是
A.由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度
B.YX3的水溶液呈弱碱性,能使湿润的蓝色石蕊试纸变红
C.原子半径:Z<Y<W,而简单离子半径:W<Y<Z
D.W的氯化物熔点低,易升华,但水溶液能导电,由此推断它属于弱电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014河南师大附中高三4月份月考理综化学试卷(解析版) 题型:简答题
(13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O=6Cu+ SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2 的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
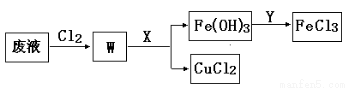
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5 mol· , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38 、 KSP [Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38 、 KSP [Cu(OH)2]=2.0×10—20 、 lg5=0.7)
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省邯郸市高二7月调研考试化学试卷(解析版) 题型:选择题
已知298K时下述反应的有关数据:C(s)+1/2 O2(g)=CO(g) △H1 = -110.5kJ·mol-1
C(s)+O2 (g)=CO2(g), △H2= -393.5kJ/mol 则 C(s)+CO2(g)=2CO(g) 的△H为
A.283. kJ·mol-1 B.+172.5 kJ·mol-1
C.-172.5 kJ·mol-1 D.-504 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省高二下学期第三次月考化学试卷(解析版) 题型:选择题
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是( )
A.NaCl的电子式为
B.NaCl的水溶液是强电解质
C.23Na37Cl中质子数和中子数之比是8:7
D.电解熔融氯化钠可得到氯气和金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com