
| n |
| V |
| ag |
| 27g/mol |
| a |
| 27 |
| a |
| 27 |
| a |
| 18 |
| ||
| V |
| a |
| 18V |
| a |
| 18V |


科目:高中化学 来源: 题型:
| A、肯定有Na2CO3,没有Ba(NO3)2 |
| B、肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| C、肯定没有Na2CO3,Ba(NO3)2 |
| D、无法判断何种为肯定或否定的杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
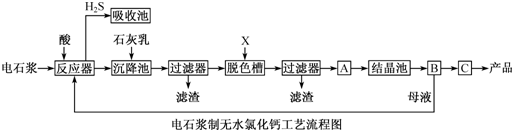
| A、反应器中加入的酸只能是盐酸 |
| B、脱色槽中应加入的X是为了脱色,所以可以选择活性炭或者过氧化钠 |
| C、氯化钙晶体CaCl2?6H2O可以直接脱水干燥得到无水CaCl2,无需在氯化氢的氛围下进行 |
| D、对设备B中产生的母液重新引入反应器,可以降低废弃物排放量,提高经济效益 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E | F | G | |
| A | - | - | - | - | - | - | ↓ |
| B | - | - | - | - | ↓ | ↓ | ↓ |
| C | - | - | - | ↓ | - | ↓ | ↓ |
| D | - | - | ↓ | - | ↓ | ↓ | ↓ |
| E | - | ↓ | - | ↓ | - | ↓ | - |
| F | - | ↓ | ↓ | ↓ | ↓ | - | ↓ |
| G | ↓ | ↓ | ↓ | ↓ | - | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 实验结果 |
| ① | 加AgNO3溶液 | 有白色沉淀生成 |
| ② | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
| ③ | 加足量BaCl2溶液时,所得沉淀为6.27g,向沉淀中加足量稀盐酸,然后干燥、称量为2.33g. | |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com