
| A. | 14g聚乙烯中所含原子数为3NA | |
| B. | 48g 甲硫醇(CH4S)中含有C-H键数目为4NA | |
| C. | 标准状况下,11.2 L氯仿所含分子数为0.5 NA | |
| D. | 0.1mol苯乙烯中含有双键的数目为0.4NA |
分析 A、聚乙烯的最简式为CH2;
B、求出甲硫醇(CH4S)的物质的量,然后根据甲硫醇(CH4S)的结构简式为CH3SH来分析;
C、标况下,氯仿为液体;
D、苯环不是单双键交替的结构.
解答 解:A、聚乙烯的最简式为CH2,故14g聚乙烯中含有的CH2的物质的量为$\frac{14g}{14g/mol}$=1mol,故含有3NA个原子,故A正确;
B、48g甲硫醇(CH4S)的物质的量为1mol,而甲硫醇(CH4S)的结构简式为CH3SH,故1mol甲硫醇中含3molC-H键即3NA条,故B错误;
C、标况下,氯仿为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、苯环不是单双键交替的结构,故苯乙烯中含1条碳碳双键,故0.1mol苯乙烯中含有的碳碳双键的个数为0.1NA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 不能跟酸反应的氧化物一定能跟碱反应 | |
| B. | 同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高 | |
| C. | 在CCl4、PCl3、HCl中各原子最外层均能达到8电子稳定结构 | |
| D. | 升高温度可以加快反应速率,其主要原因是反应物分子能量增加,活化分子百分数的增加,使有效碰撞次数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O | |
| B. | 由水电离出来的C(OH-)=10-13mol/L的溶液中加入铝粉:2Al+6H+═3H2↑+2Al3+ | |
| C. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2↓+3NO↑+6H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.4g | B. | 46.8g | C. | 40.8g | D. | 23.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
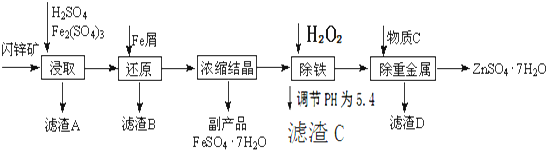

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷(无色液体,熔点9℃,密度2.2g•cm-3)的反应原理如下:
实验室制备1,2-二溴乙烷(无色液体,熔点9℃,密度2.2g•cm-3)的反应原理如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com