
【题目】下列四种酸与锌片反应,起始时生成H2反应速率最大的是
A. 10 ℃ 20 mL 3 mol/L的盐酸 B. 10 ℃ 40 mL 2 mol/L的醋酸
C. 20 ℃ 20 mL 2 mol/L的硫酸 D. 20 ℃ 10 mL 4 mol/L的硝酸
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图Ⅰ、Ⅱ分别是甲、乙两组同学将反应 “AsO43-+2I-+2H+![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。
下列叙述中正确的是( )
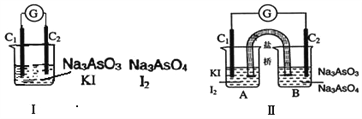
A. 甲组操作时,微安表(G)指针发生偏转
B. 甲组操作时,溶液颜色变浅
C. 乙组操作时,C2做正极
D. 乙组操作时,C1上发生的电极反应为I2+2e-=2I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应的产物中不可能存在同分异构体的是( )
A. CH3CH=CH2与HCl加成
B. CH3CH2CH2Cl在碱性溶液中水解
C. CH2=CH—CH=CH2与H2按物质的量之比为1∶1进行反应
D. ![]() 与NaOH的醇溶液共热
与NaOH的醇溶液共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,把A浸入C的硫酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为负极。A、B、C三种金属的活动性顺序为
A.A>B>CB.A>C>BC.B>A>CD.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于目前常用元素周期表的说法中正确的是( )
A.第ⅢB族元素种类最多
B.只有第3列到第12列全部是金属元素
C.周期数大于或等于族的序数时,一定是金属元素
D.是按原子的质量数由小到大的顺序编制的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色、澄清溶液中可能含有①Na+、②SO![]() 、③Cl-、④HCO3-、⑤CO
、③Cl-、④HCO3-、⑤CO![]() 、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
(1) | 用紫色石蕊试液检验 | 溶液变红 |
(2) | 向溶液中滴加BaCl2和稀HCl | 有白色沉淀生成 |
(3) | 将(2)中所得混合物过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀生成 |
下列结论正确的是
A.肯定含有的离子是②③⑥
B.该实验无法确定是否含有③
C.可能含有的离子是①③⑦
D.肯定没有的离子是④⑤,可能含有的离子是②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F具有独特的生理药理作用,实验室由芳香化合物A制备F的一种合成路线如下:
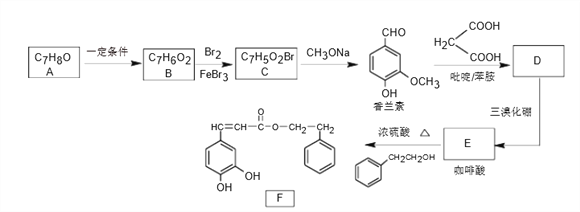
已知:①R-Br![]() R-OCH3 ②R-CHO+
R-OCH3 ②R-CHO+![]() R-CH=CH-COOH
R-CH=CH-COOH
③A能与FeCl3溶液反应显紫色
(1)A的名称为_________________,B生成C的反应类型为__________________。
(2)D的结构简式为________________________。
(3)E中含氧官能团名称为_______________。
(4)写出F与足量NaOH溶液反应的化学方程式__________________________。
(5)G为香兰素的同分异构体,其中能同时满足下列条件的共有______种。(不考虑立体异构)
①能发生银镜反应
②本环上只有3个取代基
③1molG能与足量金属钠反应产生22.4LH2(标准状况)其中核磁共振氢谱有5组峰,且峰面积比为1∶1∶2∶2∶2的结构简式__________。(写一种即可)
(6)根据上述合成中提供的信息,写出以![]() 为原料(其他试剂任选)分三步制备肉桂酸(
为原料(其他试剂任选)分三步制备肉桂酸(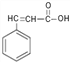 )的合成路线。_____________________________________________
)的合成路线。_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和NaCl溶液是化学工业的重要反应之一。20℃时,饱和NaCl溶液的密度为ρg·cm-3(ρ>1g·cm-3),物质的量浓度为C mol·L-1,溶质的质量分数w%,则下列说法中不正确的是
A. 温度高于20℃时,饱和NaCl溶液的密度大于ρg·cm-3
B. 此溶液中NaCl的质量分数为58.5C/(1000ρ)%
C. 20℃时,浓度小于C mol·L-1的NaCl溶液是不饱和溶液
D. 20℃时,取1L饱和NaCl溶液,加入等体积的水稀释,所得溶液的质量分数大于(w/2)%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A数值为4,则量筒中液体的体积是①,由于放置位置不当读数时俯视,读出的数值为②则①②的正确数值为__________________
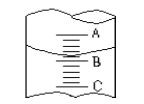
A①3.2mL、②小于3.2mL B.①4.8mL、②大于4.8mL
C.①3.2mL、②大于3.2ml D.①4.8mL、②小于4.8mL
②实验室需配制1mol·L-1的NaOH溶液220mL,在用托盘天平称取NaOH固体时,天平读数为________填代号,下同)。
A.大于8.8g B.小于8.8g C.8.8g
(2)表示溶液浓度的方法通常有两种;溶液中溶质的质量分数(W)和物质的量浓度 (c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
Ⅰ.用10%(密度为1.01g·cm3-)的氢氧化钠溶液配制成27.5g 2%的氢氧化钠溶液。
①计算:需_________g10%(密度为1.01g·cm3-)的氢氧化钠溶液
②量取:用量筒量取10%的氢氧化钠溶液_________mL
Ⅱ.把98%(密度为1.84g·cm3-)的浓硫酸稀释成2mol/L的稀硫酸100ml,回答下列问题:
①需要量取浓硫酸_______ mL
②下列实验操作使配制的溶液浓度偏低的是__________
A.容量瓶洗涤后未干燥
B.量取溶液时,仰视刻度线
C.装入试剂瓶时,有少量溶液溅出
D.没有洗涤烧杯和玻璃棒
E.定容时,加水不慎超出刻度线,又倒出一些
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com