
| A.通过提高烟囱的高度可减少污染气体的排放 |
| B.电解Al2O3过程中加入冰晶石(Na3AlF6),可降低Al2O3熔融温度 |
| C.接触法制硫酸工业中,常常采用加压来提高SO2的转化率 |
| D.氯碱工业中,电解池两电极材料必须都要用耐腐蚀导电材料 |
科目:高中化学 来源:不详 题型:实验题
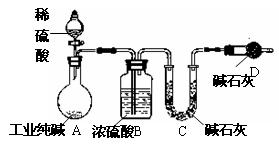
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 是一种重要的化工原料,工业上生产硝酸的主要过程如下:
是一种重要的化工原料,工业上生产硝酸的主要过程如下: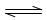 2NH3(g) △H<0
2NH3(g) △H<0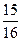 ,则N2的转化率a1= ;
,则N2的转化率a1= ;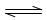 2NO2(g)△H>0
2NO2(g)△H>0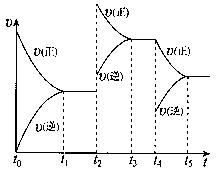
 2将NO2还原为N2。
2将NO2还原为N2。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 含量高的水浇灌农作物有许多优点,下列对其优点的分析不正确的是( )
含量高的水浇灌农作物有许多优点,下列对其优点的分析不正确的是( )| A.加速农作物的光合作用 |
| B.有利土壤中Ca、Mg元素被农作物吸收 |
| C.改良碱性土壤 |
| D.增加土壤中N、P元素含量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
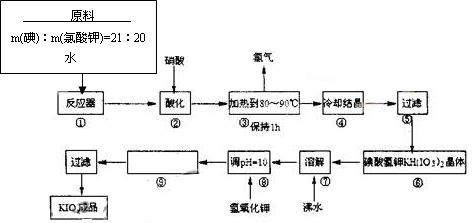
| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 种群 | 甲 | 乙 | 丙 | 丁 |
| 能量(kJ) | 2.8×109 | 1.3×108 | 9.1×107 | 2.9×107 |
| DDT浓度(ppm) | 0.04 | 0.35 | 0.39 | 3.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ΔH<0;2SO2(g)+O2(g)
2NH3(g) ΔH<0;2SO2(g)+O2(g) 2SO3(g) ΔH<0;
2SO3(g) ΔH<0;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4·1/9H2O |
| B.SO3·10/9H2O |
| C.H2SO4·SO3 |
| D.SO3·H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高纯度的单晶硅用于制造登月车的光电池和光导纤维 |
| B.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| C.加碘食盐能使淀粉溶液变蓝 |
| D.有些肾病患者要定期进行血透,血透原理是利用渗析的方法净化血液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com