
| ||
| ||
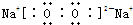 ,故答案为:
,故答案为: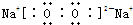 .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
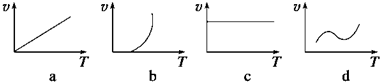
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.
取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 维生素C可溶于水,溶液呈酸性,有还原性,其结构如图所示.关于维生素C的叙述错误的是( )
维生素C可溶于水,溶液呈酸性,有还原性,其结构如图所示.关于维生素C的叙述错误的是( )| A、维生素C是有机物 |
| B、在维生素C溶液中滴入石蕊试液显蓝色 |
| C、新鲜蔬菜比煮熟的维生素C含量多 |
| D、维生素C在溶液中或受热时容易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| D、标准状况下,11.2LH2O含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com