
【题目】某校合作学习小组的同学设计实验验证钠在二氧化碳中燃烧的产物。回答下列问题:
(1)甲组同学利用下列装罝制取干燥纯净的二氧化碳。仪器X的名称是 , 装置B中盛装的试剂是。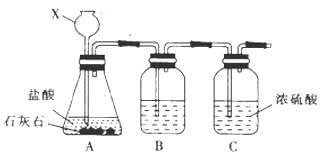
(2)乙组同学利用甲组制得的CO2并选用下列装置(可重复使用)验证钠在二氧化碳中燃烧的产物中是否含有CO。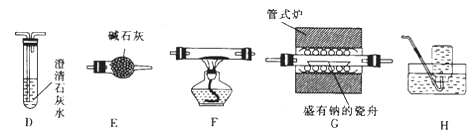
①F中盛装的试剂是。
②装置正确的连接顺序为C→→→→E→→H。
③证明燃烧的产物中含有CO的现象是。
(3)丙组同学取乙组同学在G装置中所得的固体于试管中,加入足量稀盐酸,有气体产生且试管底部有黑色不溶物,则固体产物中一定有(填化学式)。
【答案】
(1)长颈漏斗,饱和NaHCO3溶液
(2)CuO,G,E,D,F,D,F中黑色粉末变为红色(或装置F之前的D中澄淸石灰水不变浑浊,装置F之后的Ⅰ中澄淸石灰水变浑浊)
(3)Na2CO3和C
【解析】本题主要考查对于“验证钠在二氧化碳中燃烧的产物”探究实验的评价。
(1)仪器X的名称是长颈漏斗,装置B中盛装的试剂是用来除去氯化氢杂质的饱和NaHCO3溶液。
(2)①F中盛装的试剂是CuO。
②实验步骤中应先将钠在二氧化碳中燃烧的产物通过E除去剩余二氧化碳,通过D确认,再通过F使CO转化为CO2,通过D验证,所以装置正确的连接顺序为C→G→E→D→F→D→H。
③证明燃烧的产物中含有CO的现象是F中黑色粉末变为红色(或装置F之前的D中澄淸石灰水不变浑浊,装置F之后的Ⅰ中澄淸石灰水变浑浊)。
(3)该气体为二氧化碳,黑色不溶物为单质炭,则固体产物中一定有Na2CO3和C。
【考点精析】本题主要考查了钠的化学性质的相关知识点,需要掌握钠的化学性质:与非金属反应;与水反应;与酸反应;与盐溶液反应才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl﹣的位置被O2﹣代替代替.则下列关于KO2晶体结构的叙述中正确的是( ) 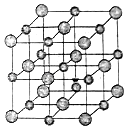
A.与K+距离相等且最近的O2﹣有8个
B.与K+距离相等且最近的O2﹣构成的多面体是六面体
C.一个KO2晶胞中的K+和O2﹣的粒子数都是4个
D.与K+距离相等且最近的K+有8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)( )
A.乙炔
B.丙炔
C.丁炔
D.丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A中含有KAl(SO4)2、Al2O3和Fe,在一定条件下可实现如图所示的物质之间的转化:
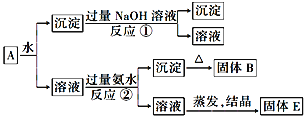
据此判断:
(1)固体B的化学式为________________,其归属的物质类别是:________________。
(2)固体E所含物质的化学式为________________。
(3)写出反应①的化学方程式:_______________________________。
(4)写出反应②的离子方程式:______________________________。
(5)某化学反应产物为Al2O3和Fe,此反应的名称是_________,化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1mol·L-1的H2A溶液中各种微粒浓度的对数值(lgc)与pH的关系如图所示。( )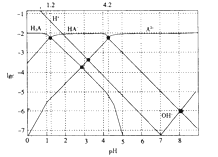
下列说法不正确的是
A.H2A是二元弱酸
B.HA-![]() H++A2-的电离平衡常数Ka=10-12
H++A2-的电离平衡常数Ka=10-12
C.0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 时:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1)NH2OH的电子式为。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl ![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺: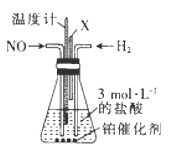
①该实验适宜的加热方式为。
②装置中导管X的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废碱渣(主要成分为Na2CO3)处理硫酸厂尾气中的SO2 , 可制得无水Na2SO3(成品),其流程如图所示。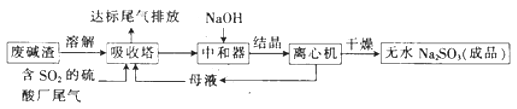
(1)某硫酸厂排放出的尾气中SO2的含量特别髙,而废碱渣的量不足,此时“吸收塔”内发生反应的离子方程式为(不考虑H2O与SO2反应)。
(2)亚硫酸钠的溶解度曲线如图所示,则上述流程中“结晶”的方法是(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为(填“浊液”“胶体”或“溶液”)。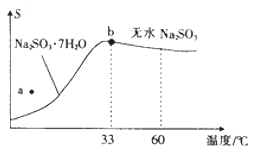
(3)仅用BaCl2、H2O2和过量稀盐酸的混合溶液难以检出“成品”中的SO32- , 原因是“成品”中含有某种杂质阴离子。
①该杂质阴离子为(填离子符号)。
②25℃时,部分钡盐的Ksp如下表所示。
化学式 | BaSO4 | BaSO3 |
Ksp | 1.1×10-10 | 5.5×10-7 |
将得到的“成品”溶于水,测得溶液中SO32-的浓度为0.5mol L-1 , 为杂质阴离子浓度的10倍,向该溶液中加入等体积、0.5mol·L-1的BaCl2溶液,充分反应后c(Ba2+)=mol L-1。(混合时溶液体积的变化忽略不计)
(4)某同学采用如下方法检验SO32-:![]()
①洗涤时使用的试剂最好为(填字母)。
a.稀HNO3 b.蒸馏水 c.稀H2SO4
②根据上述流程中的数据(w、x、y) (填“能”或“不能”)计算出成品试样中SO32-的百分含量,若能,则SO32-的百分含量为(若不能,则此空不填);若不能,则理由是(若能,则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种“光敏性高分子”材料在荧光屏及大规模集成电路中应用广泛.其结构可表示为:对该“光敏性高分子”叙述正确的是( )【﹣COO﹣基团与氢气不反应】 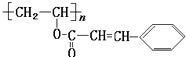
A.化学式为(C11H11O2)n
B.它能发生还原反应
C.它可以和FeCl3溶液发生显色反应
D.1mol该分子最多能和4molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com