
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1)NH2OH的电子式为。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl ![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺: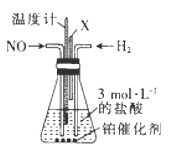
①该实验适宜的加热方式为。
②装置中导管X的作用是。
【答案】
(1)![]()
(2)既不作氧化剂又不作还原剂
(3)5NH2OH=3NH3↑+2NO↑+3H2O
(4)水浴加热,排出未反应的气体及蒸气并维持压强平衡
【解析】本题主要考查羟胺的性质、制法等。
(1)NH2OH的电子式为 ![]() 。
。
(2)该反应中NH3转化为NH4+,NH3中化合价无变化,所以NH3既不作氧化剂又不作还原剂。
(3)分解产生的无色气体遇浓盐酸产生白烟,说明该无色气体含有NH3,与空气接触变为红棕色,说明该无色气体含有NO,且其分解产物会使无水CuSO4变蓝色,说明分解产物含有水,则NH2OH分解反应的化学方程式为5NH2OH=3NH3↑+2NO↑+3H2O。
(4)①低于100℃的反应条件适于水浴加热,该实验适宜的加热方式为水浴加热。
②装置中导管X的作用是排出未反应的气体及蒸气并维持压强平衡。


科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数.
(1)有关上述常数的说法正确的是 .
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将a molL﹣1的氨水与0.01molL﹣1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl﹣),则溶液显(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=
(3)已知25℃时CH3COOH和NH3 . H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为 , 溶液中离子浓度大小关系为
(4)25℃时,H2SO3═HSO3﹣+H+的电离常数Ka=1×10﹣2molL﹣1 , 则该温度下pH=3、c(HSO3﹣)=0.1molL﹣1的NaHSO3溶液中c(H2SO3)= .
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10﹣38、1.0×10﹣11 , 向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是 . (已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计实验验证钠在二氧化碳中燃烧的产物。回答下列问题:
(1)甲组同学利用下列装罝制取干燥纯净的二氧化碳。仪器X的名称是 , 装置B中盛装的试剂是。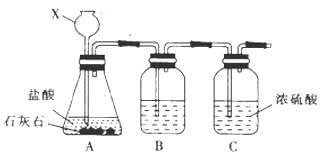
(2)乙组同学利用甲组制得的CO2并选用下列装置(可重复使用)验证钠在二氧化碳中燃烧的产物中是否含有CO。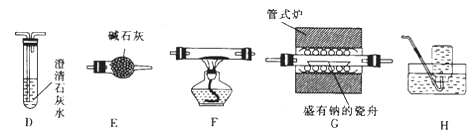
①F中盛装的试剂是。
②装置正确的连接顺序为C→→→→E→→H。
③证明燃烧的产物中含有CO的现象是。
(3)丙组同学取乙组同学在G装置中所得的固体于试管中,加入足量稀盐酸,有气体产生且试管底部有黑色不溶物,则固体产物中一定有(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯可用作合成纤维、合成橡胶、合成塑料的原料。回答下列问题:
(1)实验室用乙醇和五氧化二磷制取乙烯的过程如下:
P2O5+3H2O=2H3PO4
H3PO4+C2H5OH→C2H5OPO(OH)2(磷酸单乙醋)+H2O;
170~200 ℃时,C2H5OPO(OH)2会分解生成乙烯和磷酸。
C2H5OPO(OH)2分解反应的化学方程式为。
(2)向2 L的恒容密闭容器中充入0.1mol C2H6和0.1 molCO2 , 发生的反应为
C2H6 (g)+CO2(g) ![]() C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。
C2H4(g)+CO(g)+H2O(g),C2H6的平衡转化率与温度的关系如图所示。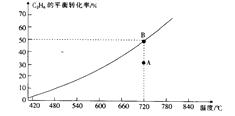
①在相应温度下,A点的反应速率v(正)(填“>”“<”或“=”)v(逆)。
②若不考虑副反应的发生,为提高C2H6的平衡转化率,除了将生成物及时从体系中分离出来外,还可采取的措施有 (任写一种)。
③720℃时,上述反应的平衡常数K=。
(3)用CrO3作催化剂,CO2重整C2H6制乙烯的反应过程如下:
C2H6(g) ![]() C2H4(g)+H2(g) △H1 ;
C2H4(g)+H2(g) △H1 ;
3H2(g)+2CrO3(s)=3H2O(g)+Cr2O3(s) △H2 ;
Cr2O3(s)+3CO2(g)=3CO(g)+2CrO3(s) △H3。
①反应:C2H6(g)+CO2(g) ![]() C2H4(g)+ CO2(g) +H2O(g)的△H=(用含△H1、△H2、△H3的代数式表示)。
C2H4(g)+ CO2(g) +H2O(g)的△H=(用含△H1、△H2、△H3的代数式表示)。
②已知部分化学键的键能数据如下表所示,则△H1=kJ·mol-1。
化学键 | C-C | C=C | C-H | H-H |
键能/kJ mol-1 | 348 | 615 | 413 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E五种有机物,它们的分子分别由﹣CH3、﹣OH、﹣COOH、﹣CHO、﹣C6H5( 代表苯基)中的两种组成,这些化合物的性质如下所述: ①A能够发生银镜反应,且相对分子质量为44;
②B溶液加入氯化铁溶液中,溶液显紫色;
③C和E在有浓硫酸存在并加热的条件下,能发生酯化反应,C和E的相对分子质量之比为8:15;
④B和E都能跟氢氧化钠溶液反应,而A、C、D则不能;
⑤D属于烃类,且D能使酸性高锰酸钾溶液褪色,还能发生硝化反应.
请回答下列问题:
(1)B,D的结构简式是:BD
(2)写出A发生银镜反应的化学方程式:
(3)C和E发生酯化反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
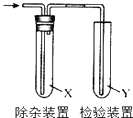
【题目】用如图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | Br2的CCl4溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com