
【题目】下列各物质溶液显酸性的是( )
A.NaHCO3
B.CH3COONa
C.NaCl
D.NH4Cl
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1)NH2OH的电子式为。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl ![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺: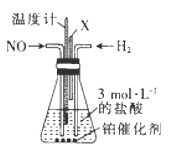
①该实验适宜的加热方式为。
②装置中导管X的作用是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )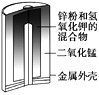
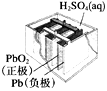
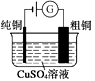
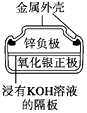
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A.图1所示电池中,MnO2的作用是催化剂
B.图2所示电池放电过程中,硫酸浓度不断增大
C.图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、现有100mL含Cu2+、Al3+、NH4+、H+、Cl-的溶液,向该溶液中逐滴加入2.5mol/LNaOH溶液,所加NaOH 溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:

(1)B点的沉淀物的化学式为______________。
(2)原溶液中Cu2+的物质的量为______,原溶液中Cl-物质的量浓度为________,x-y=__________。
Ⅱ、A、B、C、D为中学常见物质且均含有同一种元素,相互转化关系如图(反应条件及其他物质已经略去):
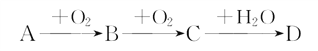
(1)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝色石蕊试纸变红。则D的化学式为___________。
(2)若A为单质,D为强碱且组成元素的原子所含质子的数目小于18,写出C→D的化学方程式:_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应不可能发生的是
A. Cu+2Fe3+==Cu2++2Fe2+ B. 10Cl-+2MnO![]() +16H+=2Mn2++5Cl2↑+8H2O
+16H+=2Mn2++5Cl2↑+8H2O
C. Cu+Cl2![]() CuCl2 D. 5Pb2++2MnO
CuCl2 D. 5Pb2++2MnO![]() +2H2O=5PbO2↓+2Mn2++4H+
+2H2O=5PbO2↓+2Mn2++4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是(填“增大”“减小”或“不变”,下同),ΔH的变化是。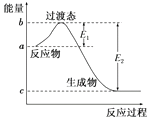
(2)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1 , 则甲醇蒸气燃烧为液态水的热化学方程式为。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO 。这两步的能量变化如图: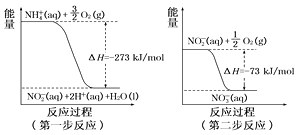
第二步反应是反应(填“放热”或“吸热”)。1 mol NH4+(aq)全部氧化成NO (aq)的热化学方程式是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com